Câu 40: Cho Cu và dung dịch H2SO4 loãng tác dụng với chất X (một loại phân bón hóa học), thấy thoát ra khí không màu hóa nâu trong không khí. Mặt khác, khi X tác dụng với dung dịch NaOH thì có khí mùi khai thoát ra. Chất X là :
A. amophot. B. ure. C. natri nitrat. D. amoni nitrat.
Câu 41: Dãy các muối amoni nào khi bị nhiệt phân tạo thành khí NH3 ?
A. NH4Cl, NH4HCO3, (NH4)2CO3. B. NH4Cl, NH4NO3 , NH4HCO3.
C. NH4Cl, NH4NO3, NH4NO2. D. NH4NO3, NH4HCO3, (NH4)2CO3.
Câu 45: Các loại liên kết có trong phân tử HNO3 là :
A. cộng hoá trị và ion. B. ion và phối trí.
C. phối trí và cộng hoá trị. D. cộng hoá trị và hiđro.
Câu 46: Trong phân tử HNO3 nguyên tử N có :
A. hoá trị V, số oxi hoá +5. B. hoá trị IV, số oxi hoá +5.
C. hoá trị V, số oxi hoá +4. D. hoá trị IV, số oxi hoá +3.
Câu 47: HNO3 tinh khiết là chất lỏng không màu, nhưng dung dịch HNO3 để lâu thường ngả sang màu vàng là do
A. HNO3 tan nhiều trong nước.
B. khi để lâu thì HNO3 bị khử bởi các chất của môi trường
C. dung dịch HNO3 có tính oxi hóa mạnh.
D. dung dịch HNO3 có hoà tan một lượng nhỏ NO2.
Câu 48: Các tính chất hoá học của HNO3 là :
A. tính axit mạnh, tính oxi hóa mạnh và tính khử mạnh.
B. tính axit mạnh, tính oxi hóa mạnh và bị phân huỷ.
C. tính oxi hóa mạnh, tính axit mạnh và tính bazơ mạnh.
D. tính oxi hóa mạnh, tính axit yếu và bị phân huỷ.
Câu 49: Dãy gồm tất cả các chất khi tác dụng với HNO3 thì HNO3 chỉ thể hiện tính axit là :
A. CaCO3, Cu(OH)2, Fe(OH)2, FeO. B. CuO, NaOH, FeCO3, Fe2O3.
C. Fe(OH)3, Na2CO3, Fe2O3, NH3. D. KOH, FeS, K2CO3, Cu(OH)2.
Câu 50: Khi cho hỗn hợp FeS và Cu2S phản ứng với dung dịch HNO3 dư, thu được dung dịch chứa các ion
A. Cu2+, S2-, Fe2+, H+, NO3-. B. Cu2+, Fe3+, H+, NO3-.
C. Cu2+, SO42-, Fe3+, H+, NO3-. D. Cu2+, SO42-, Fe2+, H+, NO3-.
Câu 51: Dãy gồm tất cả các chất khi tác dụng với HNO3 thì HNO3 chỉ thể hiện tính oxi hoá là :
A. Mg, H2S, S, Fe3O4, Fe(OH)2. B. Al, FeCO3, HI, CaO, FeO.
C. Cu, C, Fe2O3, Fe(OH)2, SO2. D. Na2SO3, P, CuO, CaCO3, Ag.
Câu 52: Khi cho kim loại Cu phản ứng với HNO3 tạo thành khí độc hại. Biện pháp nào xử lý tốt nhất để chống ô nhiễm môi trường ?
A. Nút ống nghiệm bằng bông tẩm nước. B. Nút ống nghiệm bằng bông tẩm cồn.
C. Nút ống nghiệm bằng bông tẩm giấm. D. Nút ống nghiệm bằng bông tẩm nước vôi.
Câu 53: Nước cường toan là hỗn hợp của dung dịch HNO3 đậm đặc với :
A. Dung dịch HCl đậm đặc. B. Axit sunfuric đặc.
C. Xút đậm đặc. D. Hỗn hợp HCl và H2SO4.
Câu 54: Trong phản ứng : Cu + HNO3 ® Cu(NO3)2 + NO + H2O
Số phân tử HNO3 đóng vai trò chất oxi hóa là :
A. 8. B. 6. C. 4. D. 2.
Câu 55: Tỉ lệ số phân tử HNO3 đóng vai trò chất oxi hóa và môi trường trong phản ứng sau là :
FeO + HNO3 ® Fe(NO3)3 + NO + H2O
A. 1 : 2. B. 1 : 10. C. 1 : 9. D. 1 : 3.
Câu 56: Tổng hệ số cân bằng của các chất trong phản ứng dưới đây là :
Fe3O4 + HNO3 ® Fe(NO3)3 + NO + H2O
A. 55. B. 20. C. 25. D. 50.
Câu 57: Cho sơ đồ phản ứng :
FeS2 + HNO3 ® Fe(NO3)3 + H2SO4 + NO + H2O
Sau khi cân bằng, tổng hệ số cân bằng của các chất trong phản ứng là :
A. 21. B. 19. C. 23. D. 25.
Câu 58: Cho sơ đồ phản ứng :
Fe3O4 + HNO3 ® Fe(NO3)3 + NO + H2O
Sau khi cân bằng, hệ số của các chất tương ứng là :
A. 3, 14, 9, 1, 7. B. 3, 28, 9, 1, 14.
C. 3, 26, 9, 2, 13. D. 2, 28, 6, 1, 14.
Câu 59: Cho sơ đồ phản ứng :
Cu2S + HNO3 ® Cu(NO3)2 + H2SO4 + NO + H2O
Hệ số cân bằng của Cu2S và HNO3 trong phản ứng là :
A. 3 và 22. B. 3 và 18. C. 3 và 10. D. 3 và 12.



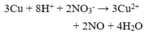
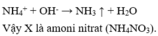


(NH4)2NO3
(nh4)2No3