Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Mg + HCl - MgCl2 + H2
Al + HCl - AlCl3 + H2
còn Cu đứng sau H nên không phản ứng với HCl.
nCuO = \(\dfrac{16}{80}=0,2\) mol
Pt: 2Cu + O2 --to--> 2CuO
0,2 mol<--------------0,2 mol
.....Mg + 2HCl --> MgCl2 + H2
0,2 mol<-----------0,2 mol
.....2Al + 6HCl --> 2AlCl3 + 3H2
....MgCl2 + 2NaOH --> Mg(OH)2 + 2NaCl
...0,2 mol<---------------0,2 mol
....AlCl3 + 3NaOH --> Al(OH)3 + 3NaCl
....Al(OH)3 + NaOH --> NaAlO2 + 2H2O
..........................................(tan)
...Mg(OH)2 --to--> MgO + H2O
0,2 mol<------------ 0,2 mol
nMgO = \(\dfrac{8}{40}=0,2\) mol
mCu = 0,2 . 64 = 12,8 (g)
mMg = 0,2 . 24 = 4,8 (g)
mAl = mhh - mCu - mMg = 20 - 12,8 - 4,8 = 2,4 (g)
% mCu = \(\dfrac{12,8}{20}.100\%=64\%\)
% mMg = \(\dfrac{4,8}{20}.100\%=24\%\)
% mAl = \(\dfrac{2,4}{20}.100\%=12\%\)

Ta có : λo = 2300Ǻ = 2,3.10-7 (m). h= 6,625.10-34 (J.s), c = 3.108 m/s.
Emax=1,5( eV) = 1,5.1,6.10-19= 2,4.10-19(J)
Mặt khác: Theo định luật bảo toàn năng lượng và hiện tượng quang điện ta có công thức
(h.c)/ λ = (h.c)/ λo + Emax suy ra: λ=((h.c)/( (h.c)/ λo + Emax)) (1)
trong đó: λo : giới hạn quang điện của kim loại
λ: bước sóng của ánh sáng chiếu vào bề mặt kim loại để bứt electron ra khỏi bề mặt kimloại.
Emax: động năng ban đầu ( năng lượng của ánh sáng chiếu vào bề mặt kim loại).
Thay số vào (1) ta có:
λ = ((6,625.10-34.3.108)/((6,625.10-34.3.108)/(2,3.10-7) + (2,4.10-19)) = 1,8.10-7(m)
= 1800 Ǻ
Thầy xem hộ em lời giải của bài này ạ, em trình bày chưa được rõ ràng mong thầy sửa lỗi cho em ạ. em cám ơn thầy ạ!
Năng lượng cần thiết để làm bật e ra khỏi kim loại Vonfram là:
E===5,4eV
Để electron bật ra khỏi kim loại thì ánh sáng chiếu vào phải có bước sóng ngắn hơn bước sóngtấm kim loại. Mà năng lượng ánh chiếu vào kim loại có E1<E nên electron không thể bật ra ngoài

Gọi số mol của Mg, Al ,Cu có trong hỗn hợp lần lượt là a, b, c (mol) (a,b,c>0)
2Mg + O2 --t*--> 2MgO (1)
...a............................a (mol)
4Al + 3O2 --t*--> 2Al2O3 (2)
...b............................b/2 (mol)
2Cu + O2 --t*--> 2CuO (3)
...c.............................c (mol)
Khi m (g) hỗn hợp 3 kim loại trên tác dụng với HCl dư => Cu không phản ứng với HCl
Mg + 2HCl ---> MgCl2 + H2 (4)
..a...................................a (mol)
2Al + 6HCl ---> 2AlCl3 + 3H2 (5)
..b....................................3b/2 (mol)
Theo đầu ta có 24a + 27b + 64c = m (I)
..........................40a + 51b + 80c = 1,72m (II)
.......................... a + 3b/2 + 0c = 0,952m/22,4 (III)
Vì m(g) là 1 đại lượng chưa biết và cả 3 pt trên đều chứa m ở vế phải nên ta có thể giả sử m=1 (g) (Khi thay
m=1 không ảnh hưởng đến % khối lượng các chất có tronh hỗn hợp)
Khi đó thay m=1 vào (I), (II) (III) ta được:
(I) <=> 24a + 27b + 64c = 1
(II) <=> 40a + 51b + 80c = 1,72
(III) <=> a + 3b/2 +0c=0,0425
Giải hệ phương trình 3 ẩn (cái này nên dùng bằng máy tính là nhanh nhất) trên ta được
a = 0,0125 (mol) => mMg = 0,3g => %Mg=0,3/1.100%=30%
b = 0,02 (mol) => mAl = 0,54g => %Al= 0,54/1.100%=54%
c = 0,0025 (mol) => mCu = 0,16g => %Cu=0,16/1.100%=16%

a) Zn + S ---> ZnS; Fe + S ---> FeS;
ZnS + H2SO4 ---> ZnSO4 + H2S; FeS + H2SO4 ---> FeSO4 + H2S
b) Gọi x, y là số mol Zn và Fe: 65x + 56y = 3,72 và x + y = 1,344/22,4 = 0,06
Giải hệ: x = 0,04; y = 0,02 ---> mZn = 65.0,04 = 2,6 g; mFe = 56.0,02 = 1,12 g.
a)Phương trình:
Zn+S→ZnS; Fe+S→FeS
ZnS+H2SO4→ZnSO4+H2S
FeS+H2SO4→FeSO4+H2S
b)Gọi m, m' là khối lượng Zn, Fe trong hỗn hợp ban đầu
m+m' = 3,72
nH2S=nZnS+nFeS=nZn+nFe=m/65+m'/56
=1,344/22,4=0,06
Bấm máy giải hệ phương trình:
m+m' = 3,72
(1/65).m+(1/56).m' = 0,06
ta được nghiệm: m = 2,6 ; m' = 1,12

Các phương trình phản ứng có thể xảy ra như sau:
Al + 3AgNO3 \(\rightarrow\) Al(NO3)3 + 3Ag (1)
0,1/3 0,1 mol
2Al(dư) + 3Cu(NO3)2 \(\rightarrow\) 2Al(NO3)3 + 3Cu (2)
0,2/3 0,1 mol
Zn + Cu(NO3)2 (dư) \(\rightarrow\) Zn(NO3)2 + Cu (3)
0,1 0,1 mol

Gọi số mol K và Al trong hỗn hợp x, y
2K + 2H2O → KOH + H2 (1)
x x (mol)
2Al + 2KOH + 2H2O → 2KAlO2 + 3H2↑ (2)
y y (mol)
Do x tan hết nên Al hết, KOH dư sau (2). Khi thêm HCl, ban đầu chưa có kết tủa vì:
HCl + KOH → KCl + H2O (3)
X – y x – y (mol)
Khi HCl trung hòa hết KOH dư thì bắt đầu có kết tủa:
KAlO2 + HCl + H2O → Al(OH)3 ↓ + KCl (4)
Vậy để trung hòa KOH dư cần 100 ml dung dịch HCl 1M.
Ta có: nHCl = nKOH dư sau phản ứng (2) = x – y = 0,1.1 = 0,1 (mol) (I)
Mặt khác: 39x + 27 y = 10,5 (II)
Từ (1) và (II) => x = 0,2; y = 0,1.
% nK = 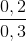 .100% = 66,67%;
.100% = 66,67%;
%nAl = 100% - 66,67% = 33,33%.
K + HOH --> KOH +1/2H2
Al + KOH + HOH --> KAlO2 +3/2H2
-Cho HCl vào bd kg có ket tua => KOH du
HCl + KOH --> KCl + HOH
-Sau đó có ket tua => KOH het => KAlO2 phan ung
KAlO2 + HCl + HOH --> Al(OH)3 + KCl
vì den 100ml dd HCl 1M co xuat hien ket tua nen => n(KAlO2) =n(HCl) = 0,1
=> n(Al) = 0,1
=> %Al = 25,71%
=> %K =74,29%
Luu y: hoi hóa xem bai giai co dung hay co van de nao kg gop ý dum nha thanks

Đáp án B.
(4) Sai, Ba là kim loại kiềm thổ còn Na là kim loại kiềm.
(5) Sai, Mg phản ứng rất chậm với nước ở nhiệt độ thường nhưng khi đun nóng Mg phản ứng mãnh liệt.

(1). Trong công nghiệp, kim loại Al được điều chế bằng phương pháp điện phân Al2O3 nóng chảy.
(2). Al(OH)3 phản ứng được với dung dịch HCl và dung dịch KOH.
(4). Trong các phản ứng hóa học, kim loại Al chỉ đóng vai trò chất khử.
(5). Các kim loại kiềm, kiềm thổ đều có màu trắng bạc và trong tự nhiên chỉ tồn tại ở dạng hợp chất.
(7). Các kim loại kiềm, kiềm thổ, nhôm đều chỉ có một số oxi hóa duy nhất trong các hợp chất.
(8). Ở nhiệt độ thường, các kim loại kiềm đều khử được nước, giải phóng H2.
đáp án B
Đáp án B.
Nhận xét đúng là: (1); (2); (4).
(3) Al là kim loại, không có tính chất lưỡng tính.
(5) Al được sản xuất trong thùng điện phân.
(6) Kim loại phổ biến nhất trong vỏ Trái Đất là Al; F đứng vị trí thứ 2.