Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi x, y tương ứng là số mol Mg và MgO: 24x + 40y = 8,8.
x + y = nMgCl2 = 28,5/95 = 0,3
Giải hệ thu được: x = 0,2; y = 0,1.
a) %Mg = 24.0,2/8,8 = 54,54%; %MgO = 100 - 54,54 = 45,46%
b) nHCl = 2(x+y) = 0,6 mol; mdd =36,5.0,6.100/14,6 = 150 gam.
c) mdd sau p.ư = 8,8 + 150 - mH2 = 158,8 - 2.0,2 = 158,4 gam.
%MgCl2 = 28,5/158,4 = 17,99%

Đáp án B
Cho phần 1 tác dụng với HCl thì thu được Y chứa muối của Al, Zn, Mg và FeCl2.
Cho AgNO3 vào Y thì thu được kết tủa AgCl và Ag.
Phần 2 tác dụng với Cl2 thu được muối gồm muối của Al, Zn, Mg và FeCl3.
Cho Z tác dụng với AgNO3 thu được 93,275 gam kết tủa AgCl.
Lượng kết tủa chênh lệch là do FeCl2 ở Y và FeCl3 ở Z.
Gọi số mol của Fe là a
![]()
![]()
=> m = 22,82 gam

Đáp án B
Cho phần 1 tác dụng với HCl thì thu được Y chứa muối của Al, Zn, Mg và FeCl2.
Cho AgNO3 vào Y thì thu được kết tủa AgCl và Ag.
Phần 2 tác dụng với Cl2 thu được muối gồm muối của Al, Zn, Mg và FeCl3.
Cho Z tác dụng với AgNO3 thu được 93,275 gam kết tủa AgCl.
Lượng kết tủa chênh lệch là do FeCl2 ở Y và FeCl3 ở Z.
Gọi số mol của Fe là a
![]()
![]()
→ m = 22 , 82 g a m

Chọn A
Bảo toàn khối lượng ở phản ứng đầu tiên: mE + mH2SO4 = mX + mY + mH2O
⇒⇒ m + 98 ∙ 1,08 = m + 85,96 + 4,4 + 18 ∙ nH2O ⇒⇒ nH2O = 0,86 mol
● Ta có: nNO + nH2 = 0,24 và 30nNO + 2nH2 = 4,4
⇒⇒ nNO = 0,14 và nH2 = 0,1
Bảo toàn H ta có: 2nH2SO4 = 4nNH4+ + 2nH2 + 2nH2O ⇒⇒ nNH4+ = 0,06 mol
● Ghép cụm ta có: nH2O = 2nNO + 3nNH4+ + nO trong Fe3O4
⇒⇒ nO trong Fe3O4 = 0,4 ⇒⇒ nFe3O4 = nO4nO4 = 0,1 mol
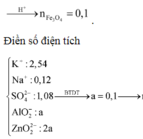
● Bảo toàn N ta có: nNaNO3 + 2nFe(NO3)2 = nNH4+ + nNO ⇒⇒ nFe(NO3)2 = 0,04 mol
● Do X phản ứng với tối đa 2,54 mol KOH nên ta có: 4nAl + 4nZn + x ∙ nFex+ + nNH4+ = 2,54
⇒⇒ 12a + x ∙ nFex+ = 2,48
Mặt khác, bảo toàn điện tích trong X ta có: x ∙ nFex+ + nNa+ + 3nAl3+ + 2nZn2+ + nNH4+ = 2nSO42–
⇒⇒ x ∙ nFex+ + 7a = 1,98
Giải hệ ta được: x ∙ nFex+ = 1,28 và a = 0,1
Vậy nFe = a = 0,1 mol và m = 0,1 ∙ 27 + 0,2 ∙ 65 + 0,1 ∙ 56 + 0,12 ∙ 85 + 0,1 ∙ 232 + 0,04 ∙ 180 = 61,9
⇒⇒ %mFe/E = 0,1∗5661,90,1∗5661,9 ≈ 9,047%

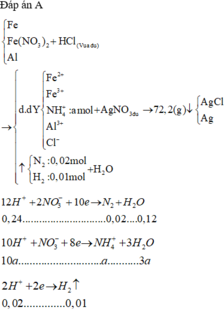


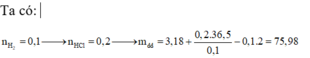


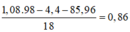
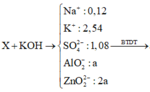
\(2Al\left(a\right)+6HCl\rightarrow2AlCl_3\left(a\right)+3H_2\left(1,5a\right)\)
\(Fe\left(b\right)+2HCl\rightarrow FeCl_2\left(b\right)+H_2\left(b\right)\)
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Gọi a,b lần lượt là số mol của Al, Fe (a,b > 0)
Ta có: \(\left\{{}\begin{matrix}1,5a+b=0,25\\27a+56b=8,3\end{matrix}\right.\Rightarrow a=b=0,1\)
\(\Rightarrow\%m_{Al}=\dfrac{2,7.100\%}{8,3}=32,53\%\)
\(\%m_{Fe}=67,47\%\)
mmuối trong dd A = 0,1(133,5 + 127) = 26,05 (g).