Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1
a)
Khí sinh ra là CO2 :
CO+ O→CO2
nBa(OH)2= 0,1 mol
\(n_{BaCO3}=\frac{9,85}{197}=0,05\left(mol\right)\)
Ta có 2 trường hợp:
TH1: Tạo 1 muối trung hòa
Ba(OH)2+ CO2→ BaCO3↓+H2O
_________0,05____0,05
⇒nCO2= 0,05 ⇒nO(FexOy)= 0,05 (1)
TH2: Tạo 2 muối
Ba(OH)2+ CO2→ BaCO3↓+H2O
0,1_____0,1______0,1
CO2+ BaCO3+H2O→ Ba(HCO3)2
0,05___0,05
⇒nCO2= 0,1+0,05= 0,15 mol ⇒nO(FexOy)= 0,15 (2)
PTHH:
Fe+ 2HCl→ FeCl2+H2↑
\(n_{FeCl2}=\frac{12,7}{127}=0,1\left(mol\right)\)
⇒ nFe= 0,1 mol
Vậy với nO= 0.05; nFe= 0,1⇒ x : y= 2:1 (loại)
với nO=0,15; nFe= 0,1⇒ x: y= 2:3 hay CTHC: Fe2O3
b)
m= 0,1.56+0,15.16=8 g
\(V=\frac{0,1.120}{2.100}=0,06l=60l\)
Câu 2:
nCO2= nBaCO3= \(\frac{27,58}{197}\)= 0,14 mol
CO+ O= CO2
\(\rightarrow\) nO (oxit)= nCO2= 0,14 mol
\(\rightarrow\)mO= 0,14.16= 2,24g
Coi oxit kim loại M gồm M và O
\(\rightarrow\) mM= 8,12-2,24= 5,88g
2M+ 2xHCl\(\rightarrow\) 2MClx+ xH2
nH2=\(\frac{2,352}{22,4}\)= 0,105 mol
\(\rightarrow\) nM= \(\frac{0,21}{x}\) mol
\(\rightarrow\)MM= \(\frac{5,88x}{0,21}\)= 28x
x=2 \(\rightarrow\) M=56. Vậy M là sắt (Fe)
FexOy+ yCO\(\underrightarrow{^{to}}\) xFe+ yCO2
nCO2= 0,14 mol \(\rightarrow\)nFexOy= 0,14/y mol
\(\rightarrow\)M FexOy= \(\frac{8,12y}{0,14}\)= 58y
Ta có pt: 56x+16y=58y
\(\Leftrightarrow\) 56x-42y=0
x=3\(\rightarrow\) y=4. Vậy CTHH oxit sắt laf Fe3O4

Dung dịch Ca(OH)2 không hấp thụ khí CO nên 6,72 lít khí thoát ra chính là khí CO dư.


1.
CTTQ : MO
CuO +CO -to-> Cu +CO2 (1)
MO +CO -to-> M+ CO2 (2)
Gỉa sử nCuO=x(mol)
=> nMO=2x(mol)
=> 80x + 2x(MM+16)=4,8
hh rắn D gồm Cu và M
3Cu +8HNO3 --> 3Cu(NO3)2 + 2NO + 4H2O (3)
3M +8HNO3 --> 3M(NO3)2 +2NO +4H2O (4)
nHNO3=0,2(mol)
Xét 2 trường hợp :
* TH1 : M ko tác dụng vs HNO3
Theo (3) : nCu=3/8nHNO3=0,075(mol)
=>nM=0,15(mol)
=> 0,075.80+0,15.(MM+ 16)=4,8
=> vô lí
*TH2: M tác dụng vs HNO3
theo (3,4) : nhh 2 kim loại=3/8nHNO3=0,075(mol)
=> x+2x=0,075=>x=0,025(mol)=>nMO=0,05(mol)
=>0,025.80+0,05.(MM+16)=4,8
=>MM=40(g/mol)
=>M :Ca
theo 93,4) : nNO=1/4nHNO3=0,05(mol)
=>V=1,12(l)

$CO + O_{oxit} \to CO_2$
$CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O$
$n_{O(oxit)} = n_{CaCO_3} = \dfrac{8}{100} = 0,08(mol)$
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$n_{Fe} = n_{H_2} = \dfrac{1,344}{22,4} = 0,06(mol)$
Ta có :
$n_{Fe} : n_O = 0,06 : 0,08 = 3 : 4$
Vậy oxit là $Fe_3O_4$
Công thức oxit sắt có dạng: \(Fe_xO_y\)
\(Fe_xO_y+yCO\rightarrow xFe+yCO_2\uparrow\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
\(\Rightarrow n_{Fe}=n_{H_2}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\)
\(\Rightarrow n_{CO}=n_{CO_2}=n_{CaCO_3}=0,08\left(mol\right)\)
\(\Rightarrow n_{O\left(Fe_xO_y\right)}=n_{O\left(CO_2\right)}-n_{O\left(CO\right)}=2n_{CO_2}-n_{CO}=0,08\left(mol\right)\)
\(\Rightarrow n_{Fe}:n_O=0,06:0,08=3:4\)
\(\Rightarrow Fe_3O_4\)

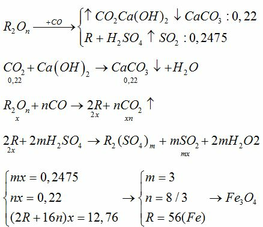
Ta có: \(n_{BaCO_3}=\dfrac{27,58}{197}=0,14\left(mol\right)\), \(n_{H_2}=\dfrac{2,352}{22,4}=0,105\left(mol\right)\)
PT: \(CO_2+Ba\left(OH\right)_2\rightarrow BaCO_3+H_2O\)
____0,14_______________0,14 (mol)
\(CO+O_{\left(trongoxit\right)}\rightarrow CO_2\)
______0,14________0,14 (mol)
Có: m oxit = mM + mO ⇒ mM = 8,12 - 0,14.16 = 5,88 (g)
Giả sử M có hóa trị n.
PT: \(2M+2nHCl\rightarrow2MCl_n+nH_2\)
Theo PT: \(n_M=\dfrac{2}{n}n_{H_2}=\dfrac{0,21}{n}\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{5,88}{\dfrac{0,21}{n}}=28n\left(g/mol\right)\)
Với n = 2 và MM = 56 (g/mol) là thỏa mãn.
Vậy M là Fe.
Có: \(n_{M\left(Fe\right)}=\dfrac{5,88}{56}=0,105\left(mol\right)\)
\(\Rightarrow n_{Fe}:n_O=0,105:0,14=3:4\)
Vậy: Oxit đó là Fe3O4.
em cảm ơn ạ