Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(2Al+6HCl \rightarrow 2AlCl_3+3H_2\\ Mg+2HCl \rightarrow MgCl_2+H_2\\ n_a=Al\\ n_b=Mg\\ m_{hh}=27a+24b=7,8(1)\\ m_{muối}=133,5a+95b=36,2(2)\\ (1)(2)\\ a=0,2\\ b=0,1\\ n_{H_2}=1,5a+b=1,5.0,2+0,1=0,4mol\\ V_{H_2}=0,4.22,4=8,96l\)

Mg + 2HCl -> MgCl2 + H2
a -> a
2Al + 6 HCl -> 2AlCl3 + 3H2
b-> 1,5b
theo đề bài ta có :
nH2 = 8,96 : 22,4 = 0,4
gọi số mol của Mg và Al lần lượt là a,b
ta có phương trình
24a+27b = 7,8
a+1,5b = 0,4
giải phương trình ta có a=0,1 : b=0,2
ta có mMg= 0,1*24=2,4 g => % Mg = 2,4: 7,8 *100 \(\approx\) 30 , 8 %
mAl = 0,2*27=5,4 g => %AL = 5,4:7,8*100 \(\approx\)69,2 %

a)
2Al + 3H2SO4 → Al2(SO4)3 +3H2
Mg + H2SO4 → MgSO4 + H2
b. n H2 = 8,96/22,4 =0,4 mol
Gọi x và y là số mol của Al và Mg ta có hệ
27x+ 24y = 7,8 (1)
1,5x+ y = 0,4 (2)
Từ 1 và 2 => x = 0,2 ; y = 0,1
Khối lượng của Al và Mg là:
mAg = 0,2.27=5,4(gam)
mMg = 7,8 – 5,4 = 2,4(gam)
c. Theo phương trình số mol của H2SO4 là : 0,3 + 0,1 = 0,4(mol)
Thể tích dung dịch H2SO4 2M đã tham gia phản ứng là:
V = 0,4/2=0,2 lít
Gọi nMg = a (mol); nAl = b (mol)
=> 24a + 27b = 7,8 (1)
nH2 = 8,96/22,4 = 0,4 (mol)
PTHH:
Mg + H2SO4 -> MgSO4 + H2
a ---> a ---> a ---> a
2Al + 3H2SO4 -> 2Al2(SO4)3 + 3H2
b ---> 1,5b ---> b ---> 1,5b
=> a + 1,5b = 0,4 (2)
(1)(2) => a = 0,1 (mol); b = 0,2 (mol)
mMg = 0,1 . 24 = 2,4 (g)
mAl = 0,2 . 27 = 5,4 (g)
nH2SO4 = 0,1 + 0,3 . 1,5 = 0,4 (mol)
VddH2SO4 = 0,3/2 = 0,2 (l)

$n_{Al} = \dfrac{8,1}{27} = 0,3(mol)$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
$FeO + H_2SO_4 \to FeSO_4 + H_2O$
$n_{H_2} = \dfrac{3}{2}n_{Al} = 0,45(mol)$
$V = 0,45.22,4 = 10,08(lít)$
\(n_{Al}=\frac{8,1}{27}=0,3mol\\ 2Al+3H_2SO_4\rightarrow Al_2(SO_4)_3 +3H_2 n_{H_2}=0,45mol\\ V=10,08l\)


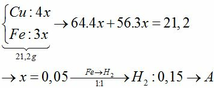
Gọi \(n_{Al}=x\left(mol\right)\\ n_{Mg}=y\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\\ Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
\(n_{AlCl_3}=n_{Al}=x\left(mol\right)\\ n_{MgCl_2}=n_{Mg}=y\left(mol\right)\)
Ta có \(\left\{{}\begin{matrix}27x+24y=7,8\\133,5x+95y=36,2\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
\(n_{H_2}=n_{Al}+n_{Mg}=0,2+0,1=0,3\left(mol\right)\\ V_{H_2\left(ĐKTC\right)}=0,3.22,4=6,72\left(l\right)\)
Chọn B.