Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(n_{CuO}=\dfrac{32}{80}=0,4\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
Xét tỉ lệ: \(\dfrac{0,4}{1}>\dfrac{0,3}{1}\) => H2 hết, CuO dư
PTHH: CuO + H2 --to--> Cu + H2O
0,3<--0,3
CuO + H2SO4 --> CuSO4 + H2O
0,1--->0,1
=> \(V_{dd.H_2SO_4}=\dfrac{0,1}{1}=0,1\left(l\right)\)

Nung nóng 30,005g hỗn hợp X gồm KMnO4, KClO3 và MnO2, sau 1 thời gian thu được khí O2 và nung nóng 24,405g chất rắn Y gồm K2MnO4, KCl. Để tác dụng hết với hh Y cần vừa đủ dd chứa 0,8 mol HCl, thu đc 4,844 lít khí Cl2 ở đktc. Tính thành phần % khối lượng KM
Sơ đồ quá trình phản ứng:
Theo bảo toàn khối lượng: mO2= 30,005 – 24,405 = 5,6 (g); ⇒ no2= 0,175 mol;
Bảo toàn e: 5x + 6y + 2z = 0,175×4 + 0,21625×2 = 1,1325;
Bảo toàn H: nH2O= 1/2nHCl = 0,4 mol;
Bảo toàn O: 4x + 3y + 2z = 0,175×2 + 0,4 = 0,75;
Theo bài ra ta có hệ pt: ⎧⎪⎨⎪⎩158x+122,5y+87z=30,0055x+6y+2z=1,13254x+3y+2z=0,75⇔⎧⎪⎨⎪⎩x=0,12y=0,0875z=0,00375{158x+122,5y+87z=30,0055x+6y+2z=1,13254x+3y+2z=0,75⇔{x=0,12y=0,0875z=0,00375
Ta thấy: 0,0875 mol KClO3 bị nhiệt phân hoàn toàn sinh 0,13125 mol O2
⇒ còn 0,04375 mol O2 nữa là do 0,0875 mol KMnO4;
⇒ %(KMnO4 đã bị nhiệt phân) = 0,08750,120,08750,12

số mol kẽm tham gia phản ứng là:\(n_{Zn}=\frac{m}{M}=\frac{6,5}{65}=0,1\left(mol\right)\)
PTHH:
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1 (mol)
a, thể tích khí hiđro thu được là:\(V_{H_2}=n_{H_2}\times22,4=0,1\times22,4=2,24\left(l\right)\)
b,khối lượng HCl cần dùng là:\(m_{HCl}=n_{HCl}\times M=0,2\times65=13\left(g\right)\)

Pt tác dụng H2SO4 loãng
CuO + H2SO4 \(\rightarrow\) CuSO4 + H2O (1)
Cu không tác dụng.
Cu + 2H2SO4đặc,n \(\rightarrow\) CuSO4 + SO2 + 2H2O (2)
nSO2= \(\frac{1,12}{22,4}\) = 0,05 mol
\(\rightarrow\) nCu= nSO2= 0,05 mol
% Cu = \(\frac{0,05x64}{10}.100\%\)= 32%
\(\rightarrow\) % CuO = 68%.

a)
\(n_{Fe}=\frac{2,24}{56}=0,04\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,04 ________________ 0,04
\(V_{H2}=0,04.22,4=0,896\left(l\right)\)
b)
\(n_{CuO}=\frac{4,2}{80}=0,0525\left(mol\right)\)
\(PTHH:CuO+H_2\rightarrow Cu+H_2O\)
TPU____0,0525__0,04________
PU____0,04____ 0,04___0,04______
SPu ___0,0125___ 0 ___ 0,04________
\(\rightarrow m_{Cr}=0,0125.80+0,04.64=3,56\left(g\right)\)
a, PTHH ( I ) : \(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{Fe}=\frac{m_{Fe}}{M_{Fe}}=\frac{2,24}{56}=0,04\left(mol\right)\)
- Theo PTHH : \(n_{H_2}=n_{Fe}=0,04\left(mol\right)\)
-> \(V_{H_2}=n_{H_2}.22,4=0,04.22,4=0,896\left(l\right)\)
b, \(n_{CuO}=\frac{m_{CuO}}{M_{CuO}}=\frac{4,2}{64+16}=0,0525\left(g\right)\)
PTHH ( II ) :........ \(CuO+H_2\rightarrow Cu+H_2O\)
Trước phản ứng :.0,0525....0,04.........
Trong phản ứng :..0,04.......0,04....
Sau phản ứng : ....0,0125.....0.........
-> Sau phản ứng H2 phản ứng hết, CuO còn dư ( dư 0,0125 mol )
- Theo PTHH ( II ) : \(n_{Cu}=n_{H_2}=0,04\left(mol\right)\)
-> \(m_{CuO}=n_{CuO}.M_{CuO}=0,04.64=2,56\left(g\right)\)
\(m_{CuO}=n_{CuO}.M_{CuO}=0,0125.\left(64+16\right)=1\left(g\right)\)
- Ta có : mchất rắn sau = mCuO dư + mCu = 1 + 2,56 = 3,56 ( g )
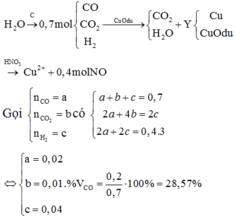
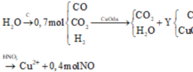
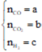 có
có