
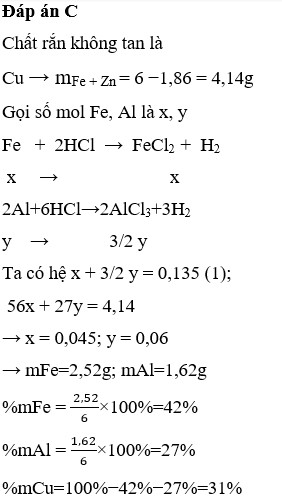
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

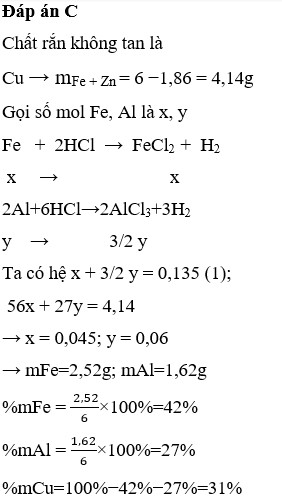

Chọn C.
Hỗn hợp X gồm Al và Fe với số mol mỗi chất bằng 0,2 mol
Hỗn hợp Y gồm Cu(NO3)2 (0,2x mol) và AgNO3 (0,2y mol)
Hỗn hợp Z gồm Ag, Cu và Fe dư Þ nFe dư = 0,1 mol và 64.0,2x + 108.0,2y = 40,8 (1)
→ BT : e 0 , 2 . 3 + 2 . ( 0 , 2 - 0 , 1 ) = 0 , 2 x . 2 + 0 , 2 y (2). Từ (1), (2) suy ra: x = 1,5

PTHH: \(Al+NaOH+H_2O\rightarrow NaAlO_2+\dfrac{3}{2}H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
\(\Rightarrow n_{Al}=0,09\left(mol\right)\) \(\Rightarrow\%m_{Al}=\dfrac{0,04\cdot27}{2,6}\cdot100\%\approx41,54\%\)
Đặt \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Cu}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow56a+64b=2,6-0,04\cdot27=1,52\) (1)
Mặt khác: \(n_{NO}=\dfrac{0,56}{22,4}=0,025\left(mol\right)\)
Bảo toàn electron: \(3a+2b=0,075\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=n_{Fe}=0,022\left(mol\right)\\b=n_{Cu}=0,0045\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,022\cdot56}{2,6}\cdot100\%\approx47,38\%\\\%m_{Cu}\approx11,08\%\end{matrix}\right.\)

Vì Z gồm 3 kim loại ⇒ Z gồm Ag, Cu, Fe.
+ Z phản ứng HCl dư ⇒ 0,05 mol H2 ⇒ nFedư = 0,05 mol
+ Sơ đồ bài toán ta có:

Đáp án A

Chọn đáp án B
Do Al3+/Al > Fe2+/Fe > Cu2+/Cu > Fe3+/Fe2+ > Ag+/Ag ||⇒ Z gồm Fedư, Cu và Ag.
⇒ nFe dư = nH2 = 0,05 mol ||► Trong X có nAl = nFe = 8,3 ÷ (27 + 56) = 0,1 mol.
⇒ dung dịch sau phản ứng chứa 0,05 mol Fe(NO3)2 và 0,1 mol Al(NO3)3.
Đặt nCu(NO3)2 = x; nAgNO3 = y ⇒ ∑nNO3– = 2x + y = 0,05 × 2 + 0,1 × 3.
mrắn không tan = 64x + 108y = 28(g) ||⇒ Giải hệ có: x = 0,1 mol; y = 0,2 mol.
⇒ [Cu(NO3)2] = 1M; [AgNO3] = 2M ⇒ chọn B.