Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right);n_{HCl}=0,5.1=0,5\left(mol\right)\\ PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ Vì:\dfrac{0,5}{2}>\dfrac{0,1}{1}\Rightarrow Zn.hết,HCldư\\ n_{HCl\left(dư\right)}=0,5-2.0,1=0,3\left(mol\right)\\ m_{HCl\left(dư\right)}=0,3.36,5=10,95\left(g\right)\)

nFe = 2.8/56 = 0.05 (mol)
nHCl = 14.6/36.5 = 0.4 (mol)
Fe + 2HCl => FeCl2 + H2
1.........2
0.05......0.4
LTL : 0.05/1 < 0.4/2
=> HCl dư
mHCl (dư) = ( 0.4 - 0.1 ) * 36.5 = 10.95 (g)
VH2 = 0.05*22.4 = 1.12 (l)
nHCl (dư) = 0.4 - 0.1 = 0.3 (mol)
mFe cần thêm = 0.3/2 * 56 = 8.4 (g)

mFe= 8,4/56= 0,15 mol
m HCl = 14,6/36,5=0,4 mol
PTHH: Fe +2HCl →FeCl2 +H2
Bđ: 0,15 0,4 0 0 mol
Pứ: o,15→0,3 0,15 0,15 mol
Sau pứ:0 0,1 0,15 0,15 mol
a. HCl dư: m =0,1.36,5=3,65 g
b. m FeCl2 = 0,15.127=19,05 g
c. m H2 = 0,15.2= 0,3 g
V H2= 0,15.22,4=3,36 (l)

a)
\(Zn + 2HCl \to ZnCl_2 + H_2\)
b)
\(n_{Zn} = \dfrac{13}{65} = 0,2(mol)\)
Ta thấy : \(\dfrac{n_{Zn}}{1} = 0,2 > \dfrac{n_{HCl}}{2} = 0,15\) nên Zn dư.
Theo PTHH :
\(n_{Zn\ pư} = 0,5n_{HCl} = 0,15(mol)\\ \Rightarrow n_{Zn\ dư} = 0,2 - 0,15 = 0,05(mol)\\ \Rightarrow m_{Zn\ dư} = 0,05.65 = 3,25(gam)\)
c)
Ta có :
\(n_{H_2} = n_{Zn\ pư} = 0,15(mol)\\ \Rightarrow V_{H_2} = 0,15.22,4 = 3,36(lít)\)

\(n_{Zn}=\dfrac{26}{65}=0,4\left(mol\right);n_{HCl}=\dfrac{21,9}{36,5}=0,6\left(mol\right)\\ PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ Vì:\dfrac{0,4}{1}>\dfrac{0,6}{2}\Rightarrow Zn.dư\\ n_{H_2}=n_{Zn\left(p.ứ\right)}=\dfrac{0,6}{2}=0,3\left(mol\right)\\ a,V_{H_2\left(đktc\right)}=0,3.22,4=6,72\left(l\right)\\ b,n_{Zn\left(dư\right)}=0,4-0,3=0,1\left(mol\right)\Rightarrow m_{Zn\left(dư\right)}=0,1.65=6,5\left(g\right)\)
`n_(Zn)=m/M=(26)/65=0,4(mol)`
`n_(HCl)=m/M=(21,9)/36,5=0,6(mol)`
`PTHH:Zn+2HCl->ZnCl_2 +H_2`
tỉ lệ: 1 ; 2 : 1 : 1
n(mol) 0,3<----0,6---->0,3----->0,3
\(\dfrac{n_{Zn}}{1}>\dfrac{n_{HCl}}{2}\left(\dfrac{0,4}{1}>\dfrac{0,6}{2}\right)\)
`=>` `Zn` dư, `HCl` hết, tính theo `HCl`
`V_(H_2)=n*22,4=0,3*22,4=6,72(l)`
`n_(Zn(dư))=0,4-0,3=0,1(mol)`
`m_(Zn(dư))=n*M=0,1*65=6,5(g)`

\(n_{Fe}=\dfrac{5,6}{56}=0,1mol\)
\(n_{HCl}=0,1\cdot1=0,1mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,1 0,1 0 0
0,05 0,1 0,05 0,05
0,05 0 0,05 0,05
\(V_{H_2}=0,05\cdot22,4=1,12k\)
Sau phản ứng Fe còn dư và dư \(m=0,05\cdot56=2,8g\)
\(C_{M_{FeCl_2}}=\dfrac{0,05}{0,1}=0,5M\)

uiii em ơi, 2p mà viết và chụp xong luôn rồi à, nhanh thật, bái phục

a) PTHH: Fe + 2HCl ===> FeCl2 + H2
b) nFe = 11,2 / 56 = 0,2 (mol)
=> nH2 = nFe = 0,2 mol
=> VH2(đktc) = 0,2 x 22,4 = 4,48 lít
c) nHCl = 2.nFe = 0,4 mol
=> mHCl = 0,4 x 36,5 = 14,6 gam
d) nFeCl2 = nFe = 0,2 mol
=> mFeCl2 = 0,2 x 127 = 25,4 gam
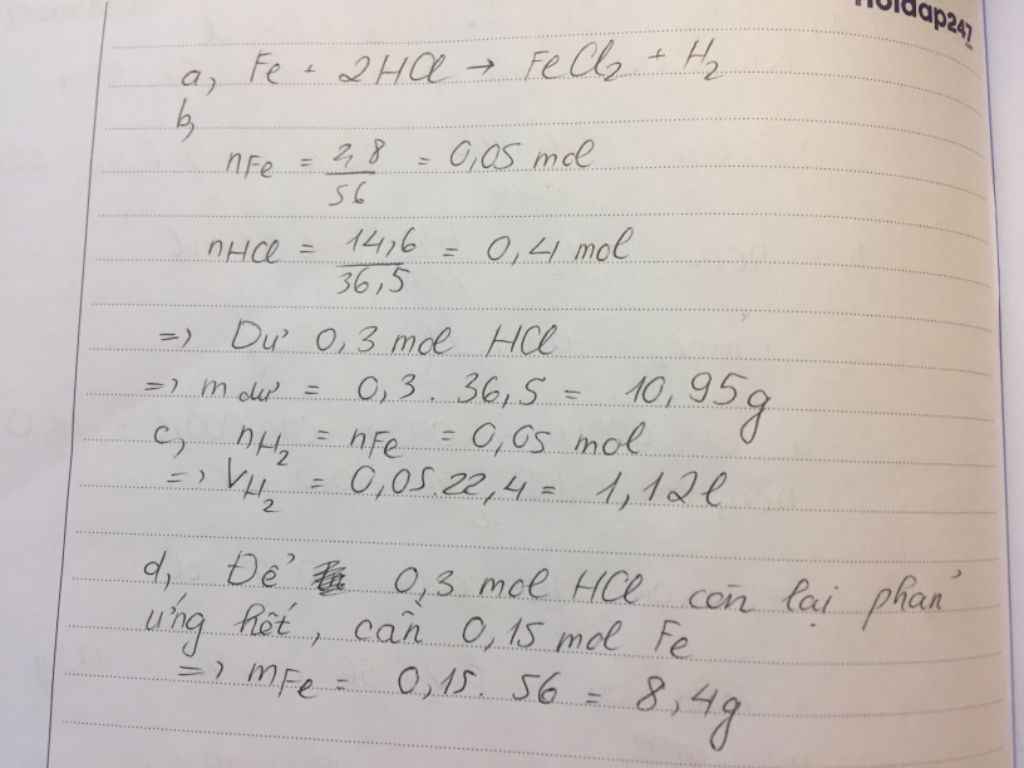
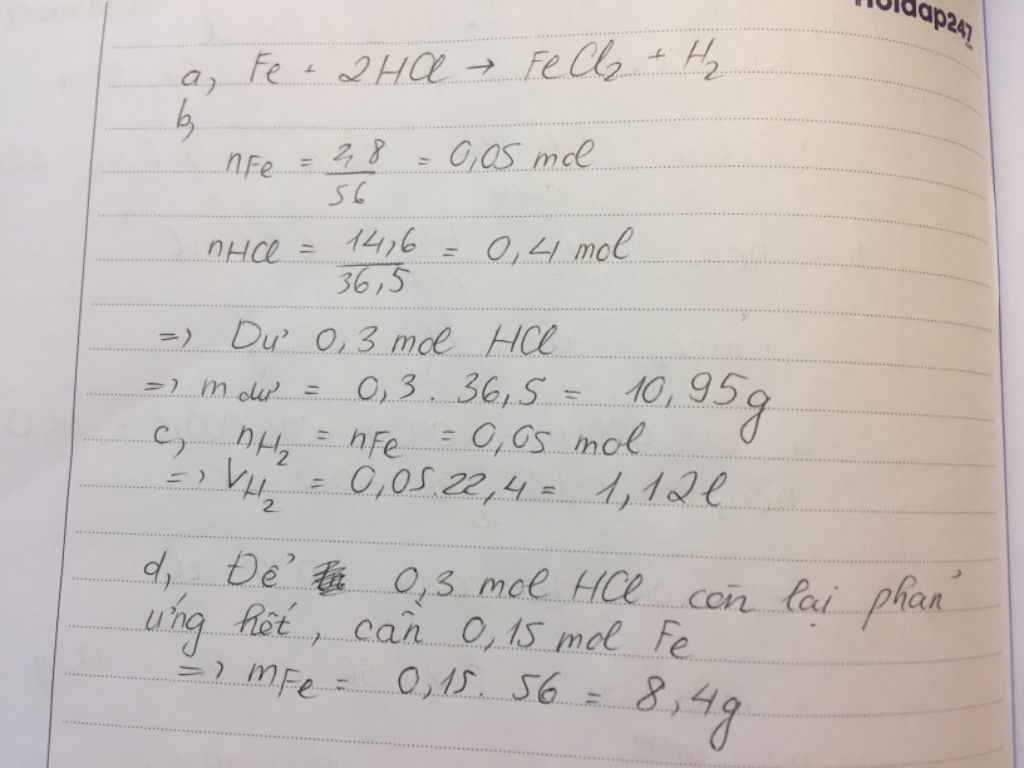
\(n_{Fe}=0,1\left(mol\right)\) \(n_{HCl}=0,1\left(mol\right)\)
\(PTHH:Fe+2HCl\rightarrow FeCl_2+H_2\)
bđ:_____0,1___0,1_____________
pứ:_____0,05__0,1____0,05____0,05_
spứ:____0,05___0_____0,05____0,05_
Chất dư là Fe: \(n_{Fe\left(du\right)}=0,05\left(mol\right)\rightarrow m_{Fe\left(du\right)}=2,8\left(g\right)\)
5.6 Fe là gì vậy bạn