Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 1:
Viết bán pư : nSO2 =0,7
\(FeO\rightarrow Fe^{3+}+3e\)
x...............x...........3x............... ( x là số mol Fe)
\(CuO\rightarrow Cu^{2+}+2e\)
y.............y.............2y................... (y là số mol Cu )
\(S^{6+}+2e\rightarrow S4^+\)
0,7.........1,4.......0,7
Tông e cho = tổng e nhận
3x +2y =1,4
Lại có 56x +64y=40
=> x=0,12 y=0,52

a) PTHH: Fe + H2SO4 ===> FeSO4 + H2
2KMnO4+10FeSO4+8H2SO4==> 5Fe2(SO4)3+8H2O+2MnSO4 + K2SO4
b) Ta có: nFe = \(\frac{5,6}{56}=0,1\left(mol\right)\)
=> nFeSO4 = 0,1 (mol)
=> nKMnO4 = \(\frac{0,1\times2}{10}=0,02\left(mol\right)\)
=> VKMnO4 = \(\frac{0,2}{1}=0,2\left(l\right)\)

1) ta có: 64*nCu+24*nMg+56*nFe=2,08.
mặt khác hh có tỉ lệ số mol 3 kloại là 2:1:1 nên
64*2*nFe+24*nFe+56*nFe=2,08---> nFe=nMg=0,01(mol)
do Cu không tác dụng với dd H2SO4 l nên:
nH2SO4 phản ứng =nMg+nFe=0,02(mol).
---> V(h2so4) là 0.02/2=0,01(lít).
khối lượng muối tạo thành =m(feso4) +m(MgSo4) =2,72(g)
V(H2) tạo thành =(0,01+0,01)*22,4=0,448(l)
2) Do 1 < nNaOH/nCO2=6/5 <2 nên sản phẩm tạo cả 2 muối.
CO2 + 2NaOH--> Na2CO3+ H2O;
CO2 + NaOH--> NaHCO3
đến đây gọi số mol của Na2CO3 và NaHCO3 lần lượt là a và b thì ta có a+b=0.025

Ta có PTHH:
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
\(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
\(Mg\left(HCO_3\right)_2+H_2SO_4\rightarrow MgSO_4+2CO_2\uparrow+2H_2O\)
\(MgSO_3+H_2SO_4\rightarrow MgSO_4+SO_2\uparrow+H_2O\)
Vì phản ứng xảy ra hoàn toàn nên
dung dịch Z là \(MgSO_4\Rightarrow m_{ddZ}=\frac{72\cdot100}{36}=200g\)
hỗn hợp khí Y gồm \(\left\{{}\begin{matrix}H_2\\CO_2\\SO_2\end{matrix}\right.\)
Ta có \(n_Y=\frac{11,2}{22,4}=0,1mol\)
\(\overline{M_Y}=d_{\frac{Y}{He}}\cdot M_{He}=8\cdot4=32\)g/mol
\(\Rightarrow m_Y=0,1\cdot32=3,2g\)
Theo BT \(SO_4^{2-}\): \(n_{H_2SO_4}=n_{MgSO_4}=\frac{72}{120}=0,6mol\\\Rightarrow m_{H_2SO_4\left(ct\right)}=98\cdot0,6=57,6g\\\Rightarrow m_{H_2SO_4\left(dd\right)}=\frac{57,6\cdot100}{30}=192g\)
Theo BTKL: \(m_X+m_{axit\left(dd\right)}=m_Z+m_Y\\ \Leftrightarrow m_X=m_Z+m_Y-m_{axit\left(dd\right)}\\ \Leftrightarrow m_X=200+3,2-192=11,2g\)
Vậy hỗn hợp X ban đầu có khối lượng m=11,2g

a. nSO2 = 0,7 mol
2Fe + 6H2SO4 ➝ Fe2(SO4)3 + 3SO2 + 6H2O
Cu + 2H2SO4 ➝ CuSO4 + SO2 + 2H2O
Gọi số mol của Fe và Cu lần lượt là x, y ta có hệ:
\(\left\{{}\begin{matrix}56x+64y=40\\\frac{3}{2}x+y=0,7\end{matrix}\right.\) ⇔ \(\left\{{}\begin{matrix}x=0,12\\y=0,52\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}m_{Fe}=6,72g\\m_{Cu}=33,28g\end{matrix}\right.\)
b. nH2SO4pứ = 0,36 + 1,04 = 1,4 mol => m = 137,2 g
c. mmuối = mFe2(SO4)3 + mCuSO4 = 107,2 g
Chú ý: Khi kim loại tác dụng với muối sắt (III) thì sẽ không giống như các trường hợp mà các em đã được học là KL + Muối \(\rightarrow\)KL mới + Muối mới.
Khi kim loại như Mg, Al, Zn tác dụng với muối sắt (III) thì sẽ xẩy ra các phản ứng như sau:
Đầu tiên muối sắt (III) --> muối sắt (II)
Mg + Fe2(SO4)3 \(\rightarrow\) MgSO4 + 2FeSO4
Nếu kim loại vẫn dư thì Muối sắt (II) --> Kim loại Fe
Mg + FeSO4 \(\rightarrow\) MgSO4 + Fe\(\downarrow\)
Hướng dẫn giải
nMg=0,2mol, nFe2(SO4)3=0,1mol
Mg + Fe2(SO4)3 \(\rightarrow\) MgSO4 + 2FeSO4
0,1.............0,1....................0,1,,,,,,,,,,,,0,2
Mg + FeSO4 \(\rightarrow\) MgSO4 + Fe\(\downarrow\)
0,1........0,1...........0,1..........0,1
Vậy mFe=0,1.56=5,6gam
m(g) chất rắn chắc là Fe á = 0.2mol
= 0.2mol mol
mol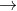 3MgSO4 + 2Fe (1)
3MgSO4 + 2Fe (1)

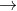 mFe= 0,133.56= 7,448(g)
mFe= 0,133.56= 7,448(g)
nMg=
nFe2(SO4)3=
ta có pt: 3Mg + Fe2(SO4)3
tpt: 3mol.... 1 mol
tđb: 0.2mol......0.1mol
tỉ lệ:
Vậy Mg p.ung hết, Fe2(SO4) dư. Tính theo Mg
Từ (1) tính theo Mg
Còn lại Fe2(SO4)3 dư thì bạn tự tính cx dựa theo pt (1) và tính số mol của nó thì lấy số mol bân đầu trừ đi số mol sau khi tính theo Mg