Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

mH2SO4=200.24,5%=49(g)
nH2SO4=\(\frac{49}{98}=0,5\left(mol\right)\)
a,PTHH:
MgO + H2SO4 \(\rightarrow\)MgSO4 + H2O
0,5 \(\leftarrow\) 0,5 \(\rightarrow\)0,5 (mol)
a,mMgO=0,5 . 40 = 20 (g)
b,mMgSO4=0,5 . 136 = 68 (g)

nZnO=8,1/81=0,1(mol)
PTHH: ZnO + H2SO4 -> ZnSO4 + H2O
0,1________0,1_____0,1(mol)
a) mH2SO4=0,1.98=9,8(g)
=> mddH2SO4=(9,8.100)/10=98(g)
b) mZnSO4=0,1.161=16,1(g)
mddZnSO4=mZnO+ mddH2SO4= 8,1+98= 106,1(g)
=> C%ddZnSO4= (16,1/106,1).100= 15,174%

BÀI7 Goi so mol MgCo3,BaCO3,MgCl2 co trong hon hp ban dau lan luot la a,b,c(mol)
MgCO3+2HCl-->MgCl2+CO2+H2O
a_____________a_____a (mol)
BaCO3+2HCl-->BaCl2+CO2+H2O
b_____________b____b (mol)
(Khi A:CO2(a+b mol)_ Dung dich B:MGCl2(a+c mol)va BaCl2:b mol)
MgCl2+2NaOH-->Mg(OH)2+2NaCl
a+c___________a+c_____2(a+c) (mol)
dung dich C:NaCL(a+b mol), BaCl2 (b mol)
Ket tua D:Mg(OH)2
Mg(OH)2 --t*->MgO+H2O
a+c________a+c (mol)
Chat ran E:MgO
CO2+Ca(Oh)2-->CaCO3+ H2O (1)
2Co2+Ca(OH)2-->Ca(HCO3)2 (2)
ta co :a+c= nMgO= 0,6/40=0,015(mol)
n Ca(Oh)2(1)=n CaCO3=0,5/100=0,005(mol)
nCa(Oh)2=0,5.o,o2=0,01(mol)
nCa(OH) (1)=0,01-0,005=0,005(mol)
=>a+b=nCO2=0,005+2.0,005=0,015(mol)
Thay a+b=0,015=>mNaCl=0,015.2.58,5=1,755(g)
=mBaCl2=3,835-1,755= 2,08(g)
=>nBaCl2=b=2,08/208=0,01(mol)
=>a=0,005(mol):c=0,01(mol)
=>mMgCO3=0,42(g)
mBaCO3=1,97(g)
mMgCl2(0,95(g)
mhh=3,34(g)
Bài 5:
Đặt a , b lần lượt là số mol của \(FeCO_3,FeO\) và \(MgO,MgCO_3\)
Theo bài ra ta có :
\(C\%_{MgSO_4}=\frac{2b.120}{\left(2a+2b\right).98:9,8\%+112a+72a+40b+84b-44.\left(a+b\right)}.100=3,76\%\)
=> a=1,8b
=> thế vào rồi tính C%

\(n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\)
a) Pt : \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O|\)
1 1 1 1
0,2 0,2 0,2
b) \(n_{H2SO4}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{H2SO4}=0,2.98=19,6\left(g\right)\)
\(C_{ddH2SO4}=\dfrac{19,6.100}{200}=9,8\)0/0
c) \(n_{CuSO4}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{CuSO4}=0,2.160=32\left(g\right)\)
\(m_{ddspu}=16+200=216\left(g\right)\)
\(C_{CuSO4}=\dfrac{32.100}{216}=14,81\)0/0

\(n_{Mg}=\dfrac{m_{Mg}}{M_{Mg}}=\dfrac{4.8}{24}=0,2mol\)
đổi 200 ml = 0,2 l
PTHH: Mg + 2HCl \(\rightarrow\) MgCl2 + H2
TL; 1 2 1 1
mol: 0,2 \(\rightarrow\) 0,2 \(\rightarrow\) 0,2
b. \(C_{M_{ddHCl}}=\dfrac{n_{HCl}}{V_{dd_{HCl}}}=\dfrac{0,2}{0,2}=1M\)
\(c.V_{H_2}=n_{H_2}.22,4=0,2.22,4=4,48l\)
\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
a) PTHH : \(Mg+2HCl\rightarrow MgCl_2+H_2\)
b) \(n_{HCl}=2n_{Mg}=0,4\left(mol\right)\Rightarrow C_{MddHCl}=\dfrac{0,4}{0,2}=2M\)
c) \(n_{Mg}=n_{H2}=0,2\left(mol\right)\Rightarrow V_{H2\left(dktc\right)}=0,2.22,4=4,48\left(l\right)\)

a. Hòa tan hết 5,6 g sắt vào dung dịch axit sunfuric 40%. Tính nồng độ phần trăm của dung dịch sau phản ứng, thể tích khí thoát ra (đktc).
\(m_{Fe}=\frac{5,6}{56}=0,1\left(mol\right)\\ PTHH:Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ m_{ddH_2SO_4}=\frac{\left(98.0,1\right).100\%}{40\%}=24,5\left(g\right)\\ m_{ddspu}=5,6+24,5=30,1\left(g\right)\\ C\%_{ddspu}=\frac{0,1.152}{30,1}.100\%=50,49\left(\%\right)\)
b. Cho 50ml dung dịch H2SO4 2M tác dụng vừa đủ với dung dịch BaCl2. Tính nồng độ mol của các chất tạo thành.
\(n_{H_2SO_4}=0,05.2=0,1\left(mol\right)\\ PTHH:H_2SO_4+BaCl_2\rightarrow BaSO_4+2HCl\\ V_{BaCl_2}=22,4.0,1=2,24\left(l\right)\\ V_{ddspu}=0,05+2,24=2,29\left(l\right)\\ C_{M_{BaSO_4}}=\frac{0,1}{2,29}=0,04\left(M\right)\\ C_{M_{HCl}}=\frac{0,2}{2,29}=0,09\left(M\right)\)
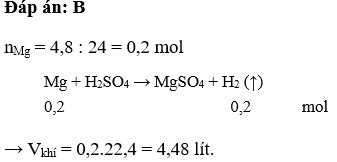
\(n_{Mg}=\dfrac{4,8}{40}=0,12\left(mol\right)\\ MgO+H_2SO_4\rightarrow MgSO_4+H_2O\\n_{MgO}=n_{MgSO_4}=0,12\left(mol\right)\\ m_{ddMgSO_4}=m_{Mg}+m_{ddH_2SO_4}=4,8+200=204,8\left(g\right)\\ m_{MgSO_4}=0,12.120=14,4\left(g\right)\\ C\%_{ddMgSO_4}=\dfrac{14,4}{204,8}.100\approx7,03\%\\ \Rightarrow C\)
C. 7,03%