Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(\left\{{}\begin{matrix}m_{Fe}=0,4m\left(g\right)\\m_{Cu}=0,6m\left(g\right)\end{matrix}\right.\)
Do sau phản ứng, KL dư => HNO3 thiếu
\(m_{KL}\) sau pư = 0,7m \(m_{Cu\left(bđ\right)}=0,6m\) => Fe dư
=> Sau pư có \(Fe^{+2}\), Fe dư và Cu k pư
Gọi số mol Fe phản ứng là a (mol)
\(n_{HNO_3}=0,2.2=0,4\left(mol\right)\)
Có: \(Fe^0-2e\rightarrow Fe^{+2}\)
____a----->2a----->a____(mol)
\(NO_3^-+4H^++3e\rightarrow NO+2H_2O\)
_______0,4 ----->0,3______________(mol)
Áp dụng ĐLBT e => 2a = 0,3
=> a = 0,15 (mol)
\(n_{Fe\left(NO_3\right)_2}=0,15\left(mol\right)\)
=> \(m_{Fe\left(NO_3\right)_2}=0,15.180=27\left(g\right)\)

Đáp án B
nSO2 = 1,7 (mol)
Chất rắn Z là Fe2O3, nFe2O3 = 0,4 (mol)
2Febđ → Fe2O3
0,8 ← 0,4 (mol)
Ta có: mX = 1,7 ×64 – 48=60,8 (gam)
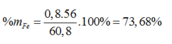

1.
\(Br_2+SO_2+2H_2O\rightarrow H_2SO_4+2HBr\)
Phần 1
\(H_2SO_4+BaCl_2\rightarrow BaSO_4+2HCl\)
0,02_____________0,02___________
\(n_{BaSO_4}=\frac{4,66}{137+32+16.4}=0,02\left(mol\right)\)
Phần 2
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4+2H_2O\)
\(Ba\left(OH\right)_2+2HBr\rightarrow BaBr_2+2H_2O\)
Ta thấy chia 2 phần bằng nhau mà kết tủa(BaSO4) phần 2 nhiều hơn phần 1
\(\rightarrow\) Phần 2 có SO2 tác dụng với Ba(OH)2
\(Ba\left(OH\right)_2+SO_2\rightarrow BaSO_3+H_2O\)
___________0,03_____0,03____________
\(m_{BaSO3}=1,17-4,66=6,5\left(l\right)\)
\(n_{BaSO3}=\frac{6,51}{137+32+16.3}=0,03\left(mol\right)\)
Tổng nSO2=2.(0,02+0,03)=0,1 (Vì chia làm 2 phần bằng nhau nên khi tính mol ban đầu phải nhân 2 nha bạn)
\(CM_{SO2}=\frac{0,1}{0,2}=0,5M\)
\(n_{Br2}=0,02.2=0,04\)
\(C\%_{Br2}=\frac{0,04.160}{32}=20\%\)
2.
a)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(BaCO_3+2HCl\rightarrow BaCl_2+CO_2+H_2O\)
\(MgCO_3+2HCl\rightarrow MgCl_2+CO_2+H_2O\)
\(BaCO_3\rightarrow BaO+CO_2\)
\(MgCO_3\rightarrow MgO+CO_2\)
b)
\(n_{hh_{khi}}=\frac{2,464}{22,4}=0,11\left(mol\right)\)
\(n_{CO2}=\frac{3,584}{22,4}=0,16\left(mol\right)\)
Gọi a là số mol Al b là số mol BaCO3 c là số mol MgCO3 trong 0,2 mol
Ta có:
\(\left\{{}\begin{matrix}a+b+c=0,2\\b+c=0,16\end{matrix}\right.\rightarrow a=0,04\left(mol\right)\)
\(\%n_{Al}=\frac{0,04}{0,2}.100\%=20\%\)
Gọi x là số mol Al y là nBaCO3 z là nMgCO3 trong 10,65 g X
Ta có
\(27x+197y=84x=10,65\)
\(1,5x+y+z=0,11\)
\(x=0,2.\left(x+y=z\right)\)
\(\rightarrow x=0,02;y=0,03;z=0,05\)
\(\%m_{Al}=\frac{0,02.27}{10,65}.100\%=5,07\%\)
\(\%m_{BaCO3}=\frac{0,03.197}{10,65}.100\%=55,49\%\)
\(\%m_{MgCO3}=39,44\%\)
3.
\(H_2+Cl_2\rightarrow2HCl\left(1\right)\)
______0,03___ 0,06
\(HCl+AgNO_3\rightarrow AgCl+HNO_3\left(2\right)\)
\(n_{AgCl}=\frac{0,17}{108+35,5}\)
\(n_{HCl\left(1\right)}=\frac{0,17}{108+35,5}.\frac{20}{5}=\frac{34}{7175}\)
\(n_{H2}=\frac{1}{22,4}\)
\(n_{Cl2}=\frac{0,672}{22,4}=0,03\left(mol\right)\)
\(H=\frac{34}{7175}/0,06.100\%=7,9\%\)
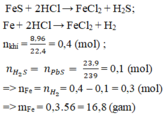
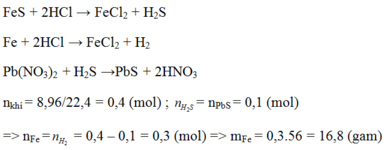
Gọi x là số mol của \(Fe\), y là số mol của \(S\)
Bảo toàn electron \(\rightarrow3n_{Fe}+6n_S=3n_{NO}\)
Theo đề bài, ta có hệ phương trình: \(\left\{{}\begin{matrix}56x+32y=47,2\\3x+6y=5,1\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}x=0,5\\y=0,6\end{matrix}\right.\)
\(n_{BaSO_4}=n_S=0,6\left(mol\right)\)
\(m_{kếttủa\left(BaSO_4\right)}=233.0,6=139,8\left(g\right)\)