Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
\(x----x------x\)
\(n_{BaCl_2}=0,2\left(mol\right);n_{H_2SO_4}=0,125.0,4=0,05\left(mol\right)\)
Vậy H2SO4 phản ứng hết
\(\Rightarrow m_{BaSO_4}=0,05.233=11,65\left(g\right)\)

\(n_{CO_2}=5.10^{-4}\left(mol\right);n_{Ca\left(OH\right)_2}=3.10^{-4}\Rightarrow n_{OH^-}=6.10^{-4}\\ Tacó:\dfrac{n_{OH^-}}{n_{CO_2}}=\dfrac{6.10^{-4}}{5.10^{-4}}=1,2\\ \Rightarrow Tạo2muối:CaCO_3,Ca\left(HCO_3\right)_2\\ Đặt:\left\{{}\begin{matrix}n_{CaCO_3}=x\left(mol\right)\\n_{Ca\left(HCO_3\right)_2}=y\left(mol\right)\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x+y=5.10^{-4}\\x+2y=6.10^{-4}\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x=4.10^{-4}\\y=10^{-4}\end{matrix}\right.\\ \Rightarrow m_{CaCO_3}=4.10^{-4}.100=0,04\left(g\right)\)

a)
$NaOH + HCl \to NaCl + H_2O$
$OH^- + H^+ \to H_2O$
b)
$n_{HCl} = 0,1.0,01 = 0,001(mol)$
$n_{NaOH} = 0,2.0,5= 0,1(mol)$
$\Rightarrow$ NaOH dư, HCl hết
$n_{NaOH\ pư} = 0,001 \Rightarrow n_{NaOH\ dư} = 0,1 - 0,001 = 0,099(mol)$
$\Rightarrow [OH^-] = \dfrac{0,099}{0,1 + 0,2} = 0,33M$
$\Rightarrow pOH = -log(0,33) = 0,48 $
$pH = 14 - pOH = 14 - 0,48 = 13,52$

nH+=0,04 mol nOH-=0,03 mol
H+ + OH- --------> H20
0,04 0,03
0,03 0,03 0,03
0,01
a/ [H+] du=0,01/0,2=0,05 M
[SO42-]=0,01/0,2=0,05 M
[K+]=0,01/0,2=0,05 M
[Ba2+]=0,01/0,2=0,05M
b/ nH+ du=0,01/0,2=0,05 M
pH=-log(0,05)=1,3
c/ khoi luong chat ran thu duoc sau phan ung la
mcr= mSO42- + mK+ + mBa2+
=0,01.96+0,01.39+0,01.137
=2,72g
ta có : \(\Sigma n_{H^+}=n_{HCl}+2n_{H_2SO_4}=0,04\left(mol\right)\)
\(\Sigma n_{OH^-}=n_{KOH}+2n_{Ba\left(OH\right)_2}=0,03\left(mol\right)\)
\(n_{SO_4^{2-}}=0,01\left(mol\right)\) ; \(n_{Ba^{2+}}=0,01\left(mol\right)\)
a, PT : \(H^++OH^-\rightarrow H_2O\)
0,03 0,03 0,03 (mol)
\(\Rightarrow n_{H^+}dư=0,01\left(mol\right)\)
đến đây tự tính đc nha. dùng ct \(CM=\dfrac{n}{V}\)
b, \(PH=-log[H^+]=-log\left(\dfrac{0,01}{0,2}\right)\simeq1,3\)
c, \(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\downarrow\)
0,01 0,01 0,01 (mol)\(mcr=m\downarrow+m_{K^+}=m_{BaSO_4}+m_{K+}=\left(0,01\times233\right)+\left(0,01\times39\right)=2,72\left(g\right)\)

PT
Fe + 2HCl → FeCl2 + H2 (1)
2NaOH + FeCl2 → 2NaCl + Fe(OH)2 (2)
theo bài ta có :
nFe=11,2 :56 =0,2 mol
=> nFeCl(pt1) =nFe=0,2 mol
mà:nFeCl2(pt1)=nFeCl2(pt2)=0,2 mol
=>nFe(OH)2 =nFeCl2=0,2 mol
=> mFe(OH)2=0,2 . 90=18 g

Đáp án A
anđehit malonic: OHC-CH2-CHO (C3H4O2)
vinyl fomat: HCOOCH=CH2 (C3H4O2)
ancol etylic: C2H6O
ancol anlylic: CH2=CH-CH2-OH (C3H6O)
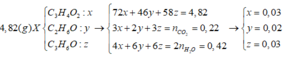
→ n A g = 4 x = 4 . 0 , 03 = 0 , 12 ( m o l ) → m A g = 12 , 96 ( g )
Tyle 4 , 82 ( g ) X → + A g N O 3 12 , 96 ( g ) A g 7 , 23 ( g ) → 19 , 44 ( g )

Đáp án C
+ Lấy 100 ml dung dịch X phản ứng với dung dịch NaOH dư, kết thúc các phản ứng thu được 19,7 gam kết tủa⇒ n BaCO3 = n Ba2+ 0,1 mol . Lấy 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, sau khi các phản ứng kết thúc thu được 29,55 gam kết tủa
⇒ n BaCO3- = n HCO3- = 0,15 mol
⇒ Trong 100ml ddX có 0,1 mol Ba2+ , 0,15 mol HCO3- .
+ Cho 200 ml dung dịch X phản ứng với lượng dư dung dịch AgNO3, kết thúc phản ứng thu được 28,7 gam kết tủa ⇒ Trong 200ml ddX có nCl- = n AgCl = 0,2 mol
⇒ Trong 50ml ddX có 0,05 mol Ba2+ ; 0,075 mol HCO3- , 0,05 mol Cl- ⇒ nK+ = 0,025
2HCO3- → CO32- + CO2 + H2O
0,075 → 0,0375 0,0375(mol)
Khi đun sôi đến cạn: mkhan = m HCO3- + m Ba2+ + m K+ + m Cl- - m CO2 – m H2O
= 0,05.137 + 0,075.61 + 0,05.35,5 + 0,025.39 – 0,0375.44 - 0,0375.18 = 11,85g