Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1.
Mg +H2SO4 --> MgSO4 +H2 (1)
nMg=0,5(mol)
a) theo (1) : nH2SO4=nMg=0,5(mol)
=> VH2SO4= 0,5 / 0,8=0,625 (l) =625(ml)
b) theo (1) : nMgSO4=nMg=0,5(mol)
=> CM dd MgSO4 = 0,5 /0,625=0,8(M)
2.
Zn +2H2SO4 --> ZnSO4 +SO2 +2H2O (1)
nZn=0,5(mol)
nH2SO4 =0,5(mol)
lập tỉ lệ :
\(\dfrac{0,5}{1}>\dfrac{0,5}{2}\)
=> Zn dư ,H2SO4 hết ==> bài toán tính theo H2SO4
theo (1) : nZn(PƯ) =nSO2 =1/2 nH2SO4 =0,25(mol)
=> nZndư =0,25(mol)
=> mZndư=16,25(g)
VSO2 (đktc)=5,6(l)

\(a,CO_2+Ba(OH)_2\to BaCO_3\downarrow+H_2O\\ b,n_{CO_2}=\dfrac{2,24}{22,4}=0,1(mol)\\ \Rightarrow n_{Ba(OH)_2}=0,1(mol)\\ \Rightarrow C_{M_{Ba(OH)_2}}=\dfrac{0,1}{0,2}=0,5M\\ c,n_{BaCO_3}=0,1(mol)\\ \Rightarrow m_{BaCO_3}=0,1.197=19,7(g)\)

Bài1
Fe +2HCl----> FeCl2 +H2
Ta có
m\(_{HCl}=\frac{14,66.200}{100}=29,32\left(g\right)\)
n\(_{HCl}=\frac{29,32}{36,5}=0,8\left(mol\right)\)
Theo pthh
n\(_{Fe}=\frac{1}{2}n_{HCl}=0,4\left(mol\right)\)
m=m\(_{Fe}=0,4.56=22,4\left(g\right)\)
Theo pthh
n\(_{FeCl2}=n_{Fe}=0,4\left(mol\right)\)
m\(_{FeCl2}=0,4.127=50,8\left(g\right)\)
m\(_{H2}=0,8\left(g\right)\)
mdd= 22,4+200=0,8=221,6(g)
C%=\(\frac{50,8}{221,6}.100\%=22,92\%\)
Chúc bạn học tốt
Bài 2
2K+2H2O--->2KOH+H2
Ta có
n\(_K=\frac{15,6}{137}=0,1\left(mol\right)\)
Theo pthh
n\(_{H2}=\frac{1}{2}n_K=0,05\left(mol\right)\)
m\(_{H2}=0,1\left(g\right)\)
m=m\(_{H2O}=200+0,1-15,6=184,5\left(g\right)\)
V\(_{H2}=0,05.22,4=1,12\left(l\right)\)
Chúc bạn học tốt

CuSO4 + 2NaOH -> Cu(OH)2 + Na2SO4 (1)
nCuSO4=0,4(mol)
Theo PTHH 1 ta có:
nNaOH=2nCuSO4=0,8(mol)
nCu(OH)2=nCuSO4=0,4(mol)
CM dd NaOH=\(\dfrac{0,8}{0,2}=4M\)
mCu(OH)2=98.0,4=39,2(g)
Cu(OH)2 -> CuO + H2O (2)
nCuO thực tế=0,1(mol)
Theo PTHH 2 ta có:
nCuO lý thuyết=nCu(OH)2=0,4(mol)
=>H=\(\dfrac{0,1}{0,4}.100\%=25\%\)
\(n_{CuSO_4}=0,2.2=0,4mol\)
CuSO4+2NaOH\(\rightarrow\)Cu(OH)2\(\downarrow\)+Na2SO4
\(n_{NaOH}=2n_{CuSO_4}=2.0,4=0,8mol\)
\(C_{M_{NaOH}}=\dfrac{n}{v}=\dfrac{0,8}{0,2}=4M\)
\(n_{Cu\left(OH\right)_2}=n_{CuSO_4}=0,4mol\)
\(m_{Cu\left(OH\right)_2}=0,4.98=39,2gam\)
Cu(OH)2\(\overset{t^0}{\rightarrow}\)CuO+H2O
\(n_{Cu\left(OH\right)_2\left(pu\right)}=n_{CuO\left(tt\right)}=\dfrac{m}{M}=\dfrac{8}{80}=0,1mol\)
\(\rightarrow H\)=\(\dfrac{0,1}{0,4}.100=25\%\)

Câu 1:
ta có pthh
2Al + 6HCl \(\rightarrow\)2 AlCl3 + 3H2 (1)
Zn + 2HCl \(\rightarrow\) ZnCl2 + H2 (2)
a, Theo đề bài ta có
nHCl=CM.V = 2.0,3=0,6 mol
Gọi x là số mol của HCl tham gia vào pthh 1
số mol của HCl tham gia vào pthh 2 là 0,6-x mol
Theo pthh 1 và 2 ta có
nAl=2/6nHCl=2/6x mol
nZn=1/2nHCl=1/2(0,6-x) mol
Theo đề bài ta có hệ pt
27.2/6x +65.1/2(0,6-x) = 12,45
\(\Leftrightarrow\) 9x + 19,5 - 32,5x = 12,45
\(\Leftrightarrow\) -23,5x=-7,05
-> x=0,3 mol
-> nAl=2/6nHCl=2/6.0,3=0,1 mol
nZn=1/2nHCl=1/2(0,6-0,3)=0,15 mol
-> %mAl=\(\dfrac{\left(0,1.27\right).100\%}{12,45}\approx21,69\%\)
%mZn=100%-21,6%=78,31%
b, Cách 1:
Theo pthh 1 và 2
nH2=1/2nHCl=1/2.0,6=0,3 mol
-> VH2=0,3.22,4=6,72 (l)
Cách 2
Theo pthh 1
nH2=1/2nHCl=1/2.0,3=0,15 mol
Theo pthh 2
nH2=nZn=1/2nHCl=1/2.0,3=0,15 mol
-> VH2(đktc)=(0,15+0,15).22,4=6,72(l)
ĐAY LÀ BÀI HÓA 8 Mà SAO ĐĂNG LÊN HÓA (9
Câu 2:
Ta có pthh
(1) Fe2O3 + 3H2SO4 \(\rightarrow\) Fe2(SO4)3 + 3H2O
(2) ZnO + H2SO4 \(\rightarrow\) ZnSO4 + H2O
a, Theo đề bài ta có
nH2SO4=CM.V=2.0,15=0,3 mol
Gọi x là số mol của H2SO4 tham gia vào pthh 1
Số mol của H2SO4 tham gia vào pthh 2 là 0,3 - x mol
Theo pth 1 và 2
nFe2O3=1/3nH2SO4=1/3x mol
nZnO = nH2SO4 = (0,3-x ) mol
Theo đề bài ta có hệ pt
160.1/3x + 81(0,3-x) = 20,15
\(\Leftrightarrow\) 53,33x + 24,3 - 81x = 20,15
\(\Leftrightarrow\) -27,67x = -4,15
-> x\(\approx\)0,15 mol
-> nFe2O3=1/3nH2SO4=1/3.0,15=0,05 mol
-> mFe2O3=0,05.160=8 g
mZnO=20,15-8=12,15 g
b, Theo pthh 1 và 2
nFe2(SO4)3=nFeO=0,05 mol
nZnSO4=nZnO=0,15 mol
-> CM\(_{Fe2\left(SO4\right)3}=\dfrac{0,05}{0,15}\approx0,333M\)
CM\(_{ZnO}=\dfrac{0,15}{0,15}=1M\)
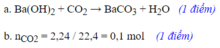
a)PTHH:\(CuO+H_2SO_4->CuSO_4+H_2O\)
a) CuO+H2SO4-->CuSO4+H2O
b) Ta có
n CuO=32/80=0,4(mol)
n H2SO4=n CuO=0,4(mol)
m dd H2SO4=\(\frac{0,4.98.100}{4,9}=800\left(g\right)\)
n CuSO4=n CuO=0,4(mol)
m CuSO4=0,4.160=64((g)
m dd sau pư=800+3,2=803,2(g_)
C% CuSO4=\(\frac{64}{803,2}.100\%=7,97\%\)