Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

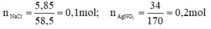
a) Phương trình hóa học của phản ứng:
NaCl + AgNO3 → AgCl↓ + NaNO3
Theo pt: nAgNO3 pư = nAgCl = nNaCl = 0,1 mol
b) Vdd = 300 + 200 = 500 ml
nAgNO3 dư = 0,2 – 0, 1 = 0,1 mol; nNaNO3 = nNaCl = 0,1 mol
CM(NaNO3) = CM(AgNO3) = 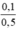 = 0,2 mol/l.
= 0,2 mol/l.

nNaCl = = 0,1 mol;
=
= 0,2 mol
a) Phương trình hóa học của phản ứng:
NaCl + AgNO3 → AgCl↓ + NaNO3
0,1 mol 0,1 mol 0,1 mol 0,1 mol
mAgCl = 143,5 x 0,1 = 14,35g
b) Vdd = 300 + 200 = 500 ml
= 0,2 - 0,1 = 0,1 mol
=
=
= 0,2 mol/l
\(n_{NaCl}=\frac{5,85}{58,5}=0,1\left(mol\right)\)
\(n_{AgNO_3}=\frac{34}{170}=0,2\left(mol\right)\)
\(NaCl+AgNO_3->AgCl+NaNO_3\) (1)
vì \(\frac{0,1}{1}< \frac{0,2}{1}\) => \(AgNO_3dư\)
theo (1) \(n_{AgCl}=n_{NaCl}=0,1\left(mol\right)\)
=> \(m_{AgCl}=143,5.0,1=14,35\left(g\right)\)
b, 300ml=0,3l , 200ml = 0,2 l
\(V_{dd}=0,3+0,2=0,5\left(l\right)\)
theo (1) \(n_{AgNO_3\left(pư\right)}=n_{NaCl}=0,1\left(mol\right)\)
=> \(n_{AgNO_3\left(dư\right)}=0,2-0,1=0,1\left(mol\right)\)
\(C_{M\left(NaNO_3\right)}=\frac{0,1}{0,5}=0,2M\)

Đáp án D
nNaCl =0,1 mol, nAgNO3 = 0,2 mol
NaCl + AgNO3 → AgCl + NaNO3
0,1 → 0,1 0,1 (mol)
Vdd = 300 + 200 = 500 ml
![]() (dư) = 0,2 - 0,1 =0, 1 (mol)
(dư) = 0,2 - 0,1 =0, 1 (mol)
![]() = 0,1 mol
= 0,1 mol
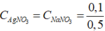 = 0,2 M
= 0,2 M

nNaCl = 5,85 /58,5 =0,1 mol.
nAgNO3 = 34 /170 = 0,2 mol.
a) Phương trình hóa học của phản ứng:
NaCl + AgNO3 \(\rightarrow\) AgCl + NaNO3
nAgCl = 0,1 mol.
mAgCl = 0,1 x 143,5 = 14,35g.
b) Vdd = 300 + 200 = 500 ml
nAgNO3 dư = 0,2 – 0, 1 = 0,1 mol.
CM(NaNO3) = CM(AgNO3) = 0,1 / 0,5 = 0,2 mol/l.

\(a.n_{CaCl_2}=0,1\left(mol\right)\\ CaCl_2+2AgNO_3\rightarrow Ca\left(NO_3\right)_2+2AgCl\\ n_{AgCl}=2n_{CaCl_2}=0,2\left(mol\right)\\ \Rightarrow m_{AgCl}=0,2.143,5=28,7\left(g\right)\\ b.n_{Ca\left(NO_3\right)_2}=n_{CaCl_2}=0,1\left(mol\right)\\ \Rightarrow CM_{CaCl_2}=\dfrac{0,1}{0,1}=1M\)

Câu 1:
Gọi số mol NaCl, KCl là a, b (mol)
=> 58,5a + 74,5b = 6,81 (1)
\(n_{AgCl}=\dfrac{14,35}{143,5}=0,1\left(mol\right)\)
Bảo toàn Cl: a + b = 0,1 (2)
(1)(2) => a = 0,04 (mol); b = 0,06 (mol)
\(\left\{{}\begin{matrix}m_{NaCl}=0,04.58,5=2,34\left(g\right)\\m_{KCl}=0,06.74,5=4,47\left(g\right)\end{matrix}\right.\)
Câu 2:
Gọi số mol MgCl2, KCl là a, b (mol)
=> 95a + 74,5b = 3,93 (1)
25ml dd A chứa \(\left\{{}\begin{matrix}MgCl_2:0,05a\left(mol\right)\\KCl:0,05b\left(mol\right)\end{matrix}\right.\)
nAgNO3 = 0,05.0,06 = 0,003 (mol)
=> nAgCl = 0,003 (mol)
Bảo toàn Cl: 0,1a + 0,05b = 0,003 (2)
(1)(2) => a = 0,01 (mol); b = 0,04 (mol)
\(\left\{{}\begin{matrix}\%m_{MgCl_2}=\dfrac{0,01.95}{3,93}.100\%=24,173\%\\\%m_{KCl}=\dfrac{0,04.74,5}{3,93}.100\%=75,827\%\end{matrix}\right.\)

nKCl = 0,1 . 1 = 0,1 (mol)
nAgNO3 = 0,2 . 1 = 0,2 (mol)
PTHH: AgNO3 + KCl -> AgCl + KNO3
LTL: 0,1 < 0,2 => AgNO3 dư
nAgNO3 (p/ư) = nAgCl = nKNO3 = 0,1 (mol)
nAgNO3 (dư) = 0,2 - 0,1 = 0,1 (mol)
Vdd (sau p/ư) = 0,1 + 0,2 = 0,3 (l)
CMAgNO3 = 0,1/0,3 = 0,33M
CMAgCl = 0,1/0,3 = 0,33M
CMKNO3 = 0,1/0,3 = 0,33M


a) \(n_{NACl}=\frac{5,85}{58,5}=0,1\left(mol\right)\)
\(n_{AgNO_3}=\frac{34}{170}=0,2\left(mol\right)\)
\(NaCl+AgNO_3\rightarrow AgCl\downarrow+NaNO_3\)
0,1 \(\rightarrow\) 0,1 \(\rightarrow\) 0,1 \(\rightarrow\) 0,1 (mol)
\(m_{AgCl}=143,5.0,1=14,35g\)
b) \(V_{dd}=300+200=500\left(ml\right)\)
\(C_M\left(NaNO_3\right)=C_M\left(AgNO_3\right)=\frac{0,1}{0,5}=0,2\left(M\right)\)
a)nNaCl=0,1 mol , nAgNO3=0,2 mol
NaCl+AgNO3---->AgCl+NaNO3
theo pt và theo bài ra: NaCl hết, AgNO3 dư 0,1 mol
=> nAgCl=nNaCl=0,1=>mAgCl=14,35 gam.
b) thể tích sau phản ứng=200+300=500 ml= 0,5 lít
Nồng độ CMAgNO3=CMNaNO3=0,1/0,5=0,2.