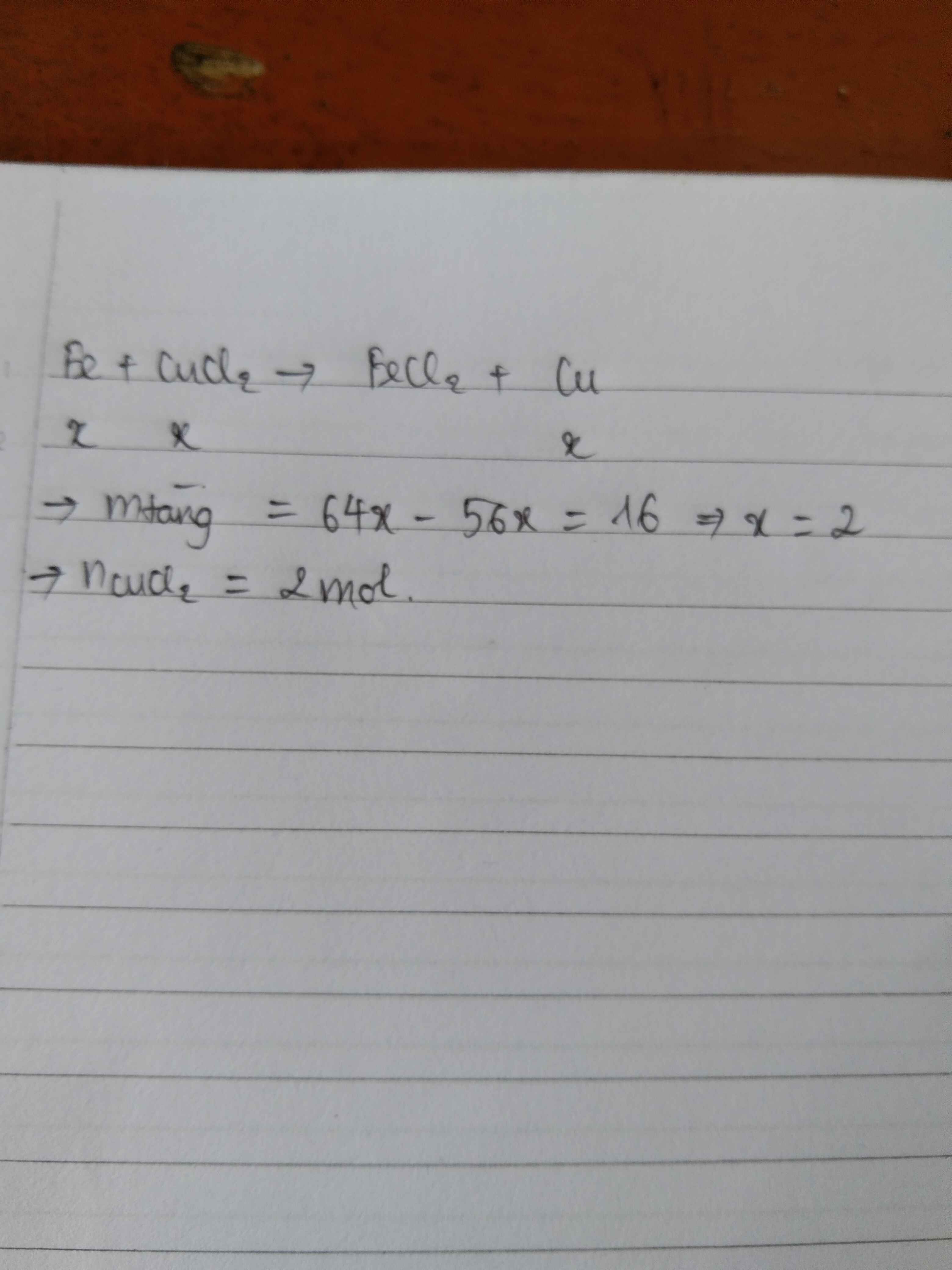Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: \(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
Đặt \(n_{Fe\left(phản.ứng\right)}=x\left(mol\right)=n_{Cu\left(tạo.ra\right)}\)
\(\Rightarrow64x-56x=0,8\) \(\Rightarrow x=0,1\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe\left(phản.ứng\right)}=0,1\cdot56=5,6\left(g\right)\\m_{Cu\left(tạo.ra\right)}=0,1\cdot64=6,4\left(g\right)\end{matrix}\right.\)

Fe + CuSO4 -> FeSO4 + Cu (1)
Đặt nFe tham gia PƯ =a
Ta có:
64a-56a=0,08
=>a=0,01
mFe=56.0,01=0,56(g)
mCuSO4=160.0,01=1,6(g)

\(Fe\left(x\right)+CuSO_4\rightarrow FeSO_4+Cu\left(x\right)\)
Khối lượng thanh sắt tăng thêm đúng bằng khối lượng Cu thêm vào trừ đi khối lượng Fe tham gia phản ứng.
Gọi số mol của Fe tham gia phản ứng là x
\(64x-56x=51-50=1\)
\(\Leftrightarrow x=0,125\)
\(\Rightarrow m_{Fe\left(pứ\right)}=56.0,125=7\)

\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
1,5 1,5 1,5 1,5
\(n_{H_2}=\dfrac{33,6}{22,4}=1,5\left(mol\right)\)
\(a,m_{Fe}=1,5.56=84\left(g\right)\)
\(m_{H_2SO_4}=1,5.98=147\left(g\right)\)
\(b,m_{FeSO_4}=1,5.152=228\left(g\right)\)

a) Khi ngâm lá sắt vào dung dịch X thì không thấy khí thoát ra nên Cuo và H2SO4 phản ứng vừa đủ với nhau .
\(CuO+H_{2^{ }_{ }}SO_{4_{ }}\rightarrow CuSO_{4_{ }}+H_2O\left(1\right)\)
Khi dung dịch X không còn màu xanh thì CuSO4 đã phản ứng hết
\(CuSO_4+Fe\rightarrow FeSO_{4_{ }}+Cu\left(2\right)\)
Theo phản ứng (1) và (2)
\(n_{Cuo}=n_{H_2SO_4}=n_{CuSO_4}=n_{Cu}=\frac{2}{64-56}=0,25\left(mol\right)\)
Nồng độ phần trăm của dung dịch H2SO4
\(C\%_{H_2SO_4}=\frac{0,25.98}{122,5}.100\%=20\%\Rightarrow C=20\)
b) Khối lượng của dung dịch sau phản ứng:
\(m_{dd}=m_{CuO}+m_{ddH_2SO_4}-\left(m_{Cu}-m_{Fe}\right)=20+122,5-2=140,5\left(g\right)\)
Theo phản ứng (2) :
\(n_{FeSO_4}=n_{Cu}=0,25\left(mol\right)\Rightarrow m_{FeSO_4}=0,25.152=38\left(g\right)\)
Nồng độ phần trăm của dung dịch sau khi lấy sắt ra là:
\(C\%_{FeSO_4}=\frac{38}{140,5}.100\%=27,05\%\)

Gọi \(n_{CuSO_4} = 0,1a(mol)\\\)
\(Fe + CuSO_4 \to FeSO_4 + Cu\)
Theo PTHH :
\(n_{Cu} = n_{Fe\ pư}= 0,1a(mol) \\ \Rightarrow 64.0,1a -56.0,1a = 1,6\\ \Rightarrow a = 2(M)\\ \)