Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Áp dụng phương pháp khối lượng mol trung bình, ta có
M = ![]() = 32
= 32
24 = M1 < 32 < M2 = 40

Đáp án B
Hướng dẫn Áp dụng phương pháp khối lượng mol trung bình, ta có
![]()
→ 24= M1 < 32 <M2 = 40

Gọi công thức chung của 2 muối là RCO3
PTHH: \(RCO_3+2HCl\rightarrow RCl_2+H_2O+CO_2\uparrow\)
a) Theo PTHH: \(n_{RCO_3}=n_{RCl_2}\)
\(\Rightarrow\dfrac{13,4}{\overline{M}_R+60}=\dfrac{15,05}{\overline{M}_R+71}\) \(\Rightarrow\overline{M}_R\approx29,33\left(đvC\right)\)
Mà 2 kim loại thuộc 2 chu kì liên tiếp
\(\Rightarrow\) 2 kim loại cần tìm là Magie và Canxi
b) Mình không biết CaCl2 có tác dụng với NaOH hay không nên thôi !

Gọi X là tên chung của 2 kloại
Vì x thuộc IIA nên pt:X+HCl=XCl2+H2
nH2=0,2
Mà nX=6,4/X
Theo pt nx=nh2 nên 6,4/X=0,2
X=32
Mà X là kl mol trb của 2 klaọi nên kl1<x<kl2
Nên hai kloại là Mg vs Ca

Gọi X là kim loại trung bình:
\(X+H_2SO_4\rightarrow XSO_4+H_2\)
\(n_X=\dfrac{2}{X}\left(mol\right);n_{XSO_4}=\dfrac{8,72}{X+96}\left(mol\right)\)
Theo pt: nX = nXSO4
\(\Rightarrow\dfrac{2}{X}=\dfrac{8,72}{X+96}\)
\(\Rightarrow X=29\)
Vì 2 kim loại ở 2 chu kì liên tiếp và thuộc nhóm IIA
Vậy 2 kim loại là Mg và Ca

Đáp án B
Số mol H2 thu được là: n H 2 = 4 , 48 22 , 4 = 0 , 2 m o l
Gọi M là kim loại chung cho hai kim loại nhóm IIA
Hai kim loại nhóm IIA đều hóa trị II => M cũng hóa trị II
Sơ đồ phản ứng: M 0 + H C + 1 l → + M C l 2 + 2 + H 2 0
Các quá trình nhường, nhận electron:
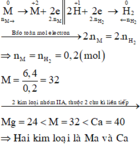

Gọi M là kim loại trung bình của 2 kim loại cần tìm. Ta có:
M + H2SO4 ---> MSO4 + H2
2 98x 8,72 2x
Gọi x là số mol M phản ứng. Áp dụng định luật bảo toàn khối lượng ta có: 2 + 98x = 8,72 + 2x. Suy ra x = 0,07 mol.
Như vậy, khối lượng trung bình của kim loại M = 2/0,07 = 28,57. Vì hai kim loại ở nhóm IIA mà thuộc 2 chu kỳ liên tiếp nên hai kim loại đó là Mg và Ca.
Cách khác nhé