Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(n_{Zn}=\dfrac{16,25}{65}=0,25\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,25-------------------->0,25
=> VH2 = 0,25.22,4 = 5,6 (l)
b)
PTHH: CuO + H2 --to--> Cu + H2O
0,25--->0,25
=> mCu = 0,25.64 = 16 (g)

\(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
PTHH :
\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
0,3 0,3
\(a,V_{H_2}=0,3.22,4=6,72\left(l\right)\)
\(b,PTHH:\)
\(3H_2+Fe_2O_3\underrightarrow{t^o}2Fe+3H_2O\)
trc p/u: 0,3 0,12
p/u: 0,3 0,1 0,2 0,3
sau : 0 0,02 0,2 0,3
----> Fe2O3 dư
\(n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12\left(mol\right)\)
\(n_{Fe}=0,2.56=11,2\left(g\right)\)

a) số mol của 19,5 gam Zn:
\(n_{Zn}=\dfrac{m}{M}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
Tỉ lệ : 1 : 1 : 1 : 1
0,3-> 0,3 : 0,3 : 0,3
thể tích của 0,3 mol H2:
\(V_{H_2}=n.22,4=0,3.22,4=6,72\left(l\right)\)
b) số mol của 19,2 gam Fe2O3:
\(n_{Fe_2O_3}=\dfrac{m}{M}=\dfrac{19,2}{160}=0,12\left(mol\right)\)
PTHH:
\(3H_2+Fe_2O_3\underrightarrow{t^o}2Fe+3H_2O\)
3 : 1 : 2 : 3
0,12-> 0,04 : 0,08 : 0,12 (mol)
Khối lượng của 0,08 mol Fe:
\(m_{Fe}=n.M=0,08.56=4,48\left(g\right)\)
PTHH: Zn + 2HCl ---> ZnCl₂ + H₂
1 2 1 1 ( mol)
a):Số mol Zn: nZn = 19,5 ÷ 65 = 0,3 mol.
Theo PTHH => Số mol H₂: nH₂ = 0,3 × 1 ÷ 1 = 0,3 mol
=> Thể tích H₂ (đktc): V = n × 22,4 = 0,3 × 22,4 = 6,72 lít
b) PTHH: Fe₂O₃ + 3H₂ --> 2Fe + 3H₂O
1 3 2 3 (mol)
*Lm tương tự nhưng thay vì tính thể tích thì tính KL Fe

\(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\\
pthh:Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,3 0,3
\(V_{H_2}=0,3.22,4=6,72l\\ n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12g\\ pthh:Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\\ LTL:\dfrac{0,12}{1}>\dfrac{0,3}{3}\)
=> Fe2O3 dư
\(n_{Fe}=\dfrac{2}{3}n_{H_2}=0,2\left(mol\right)\\
m_{Fe}=0,2.56=11,2g\)
a.\(n_{Zn}=\dfrac{19,5}{65}=0,3mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,3 0,3 ( mol )
\(V_{H_2}=0,3.22,4=6,72l\)
b.\(n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12mol\)
\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
0,12 > 0,3 ( mol )
0,3 0,2 ( mol )
\(m_{Fe}=0,2.56=11,2g\)

a) \(n_{Zn}=\dfrac{26}{65}=0,4\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,4-->0,8----->0,4--->0,4
=> VH2 = 0,4.22,4 = 8,96 (l)
b) mZnCl2 = 0,4.136 = 54,4 (g)
c) \(C\%=\dfrac{0,8.36,5}{200}.100\%=14,6\%\)

2Al+3H2SO4->Al2(SO4)3+3H2
0,2-----------------------------------0,3
n Al=0,2 mol
=>VH2=0,3.22,4=6,72l
b)
XO+H2-to>X+H2O
0,3-------------0,3
=>0,3=\(\dfrac{19,5}{X}\)
=>X là Zn( kẽm)
a.\(n_{Al}=\dfrac{5,4}{27}=0,2mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,2 0,3 ( mol )
\(V_{H_2}=0,3.22,4=6,72l\)
b.\(n_X=\dfrac{19,5}{M_X}\)
\(XO+H_2\rightarrow\left(t^o\right)X+H_2O\)
\(\dfrac{19,5}{M_X}\) \(\dfrac{19,5}{M_X}\) ( mol )
Ta có:
\(\dfrac{19,5}{M_X}=0,3\)
\(\Leftrightarrow M_X=65\)
=> X là kẽm (Zn)

\(n_{H_2}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(.........0.6............0.3\)
\(C_{M_{HCl}}=\dfrac{0.6}{0.3}=2\left(M\right)\)
\(n_{Fe_2O_3}=\dfrac{48}{160}=0.3\left(mol\right)\)
\(Fe_2O_3+3H_2\underrightarrow{^{t^0}}2Fe+3H_2O\)
\(1..............3\)
\(0.3..........0.3\)
\(LTL:\dfrac{0.3}{1}>\dfrac{0.3}{3}\Rightarrow Fe_2O_3dư\)
\(n_{Fe}=\dfrac{2}{3}n_{H_2}=\dfrac{2}{3}\cdot0.3=0.2\left(mol\right)\)
\(m_{Fe}=0.2\cdot56=11.2\left(g\right)\)

1.\(n_{Zn}=\dfrac{13}{65}=0,2mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2 0,2 ( mol )
\(V_{H_2}=0,2.22,4=4,48l\)
2.\(n_{CuO}=\dfrac{12}{80}=0,15mol\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,15 < 0,2 ( mol )
0,15 0,15 ( mol )
\(m_{Cu}=0,15.64=9,6g\)
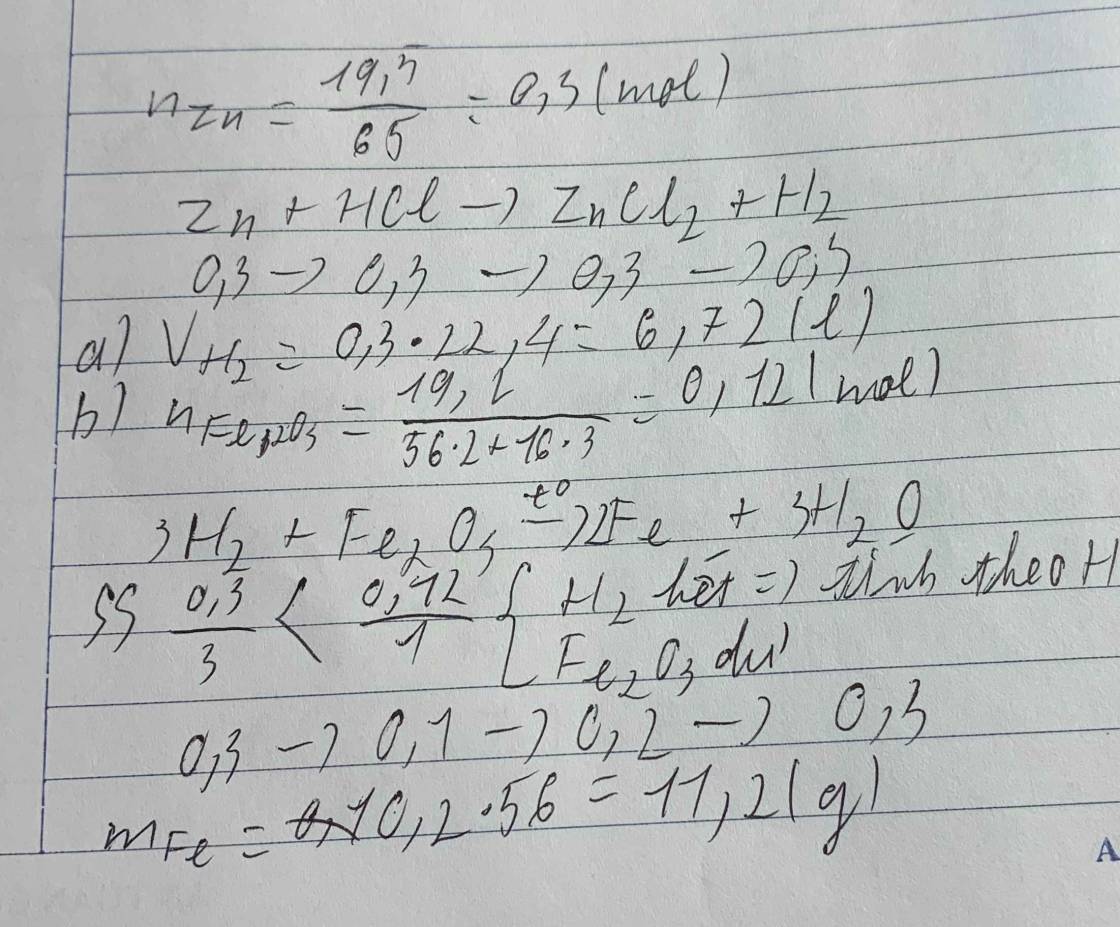
PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Ta có: \(n_{Zn}=\dfrac{26}{65}=0,4\left(mol\right)=n_{H_2}=n_{CuO}\)
\(\Rightarrow\left\{{}\begin{matrix}m_{CuO}=0,4\cdot80=32\left(g\right)\\V_{H_2}=0,4\cdot22,4=8,96\left(l\right)\end{matrix}\right.\)
\(Zn + 2HCl \to ZnCl_2 + H_2\\ n_{H_2} = n_{Zn} = \dfrac{26}{65} = 0,4(mol)\\ \Rightarrow V_{H_2} = 0,4.22,4 = 8,96\ lít\\ CuO + H_2 \xrightarrow{t^o} Cu + H_2O\\ n_{CuO} = n_{H_2} = 0,4(mol)\\ \Rightarrow m_{CuO} = 0,4.80 = 32\ gam\)