Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1.
Gọi hóa trị của kim loại M là n, ta có:
\(2M+nCl_2\underrightarrow{^{to}}2MCl_n\)
Dựa vào pt, ta thấy:
nM=nMCln
⇔ 3,2/M=6,75/M+35,5n
⇔ M=32n
Vì M là kim loại nên hóa trị có thể là I, II và III:
- Nếu n=1 ==> M=32 (Loại)
- Nếu n=2 ==> M=64 (Chọn - Cu)
- Nếu n=3 ==> M=96 (Loại)
Vậy kim loại M là Cu.
2.
\(Cu+X_2\underrightarrow{^{to}}CuX_2\)
nX2=2,24/22,4=0,1 (mol)
nCuX2=nX2=0,1 (mol)
==> mCuX2= 0,1.(64 + 2X)=22,4
==> X= 80 (Br)
Vậy halogen X là Br.
Cho 2,24lit halogen X2 ở đktc tác dụng vừa đủ với magie thu được 9,5 g mgX2 .tìm nguyên tố halogen X

Mg + X2 -> MgX2
nX2 = 2,24/22,4 = 0,1 ( mol )
=> nMgX2 = 0,1 ( mol )
=> M = 9,5 / 0,1 = 95 ( đvC )
mà : MgX2 = 24 + X.2 = 95
=> X = 35,5 ( Cl )
Đó là Clo
nX2 = 2,24/22,4 = 0,1 (mol)
PTHH: Mg + X2 -> (t°) MgX2
nMgX2 = nX2 = 0,1 (mol)
M(MgX2) = 9,5/0,1 = 95 (g/mol)
<=> 24 + X . 2 = 95
<=> X = 35,5
<=> X là Cl

\(Cu+X2-->CuX2\)
\(n_{Cu}=\frac{13,44}{64}=0,21\left(mol\right)\)
\(n_{X2}=n_{Cu}=0,21\left(mol\right)\)
\(M_{X2}=\frac{33,6}{0,21}=160\)
\(=>X=80\left(Br\right)\)
Vậy......
Câu 6
\(2Na+X2-->2NaX\)
\(m_{X2}=m_{muối}-m_{Na}=9-1,38=7,62\)
\(n_{Na}=\frac{1,38}{23}=0,06\left(mol\right)\)
\(n_{X2}=\frac{1}{2}n_{Na}=0,03\left(mol\right)\)
\(M_{X2}=\frac{7,62}{0,03}=245=>X=127\left(I\right)\)

4) \(m_{Cl_2}=43,25-18,4=24,85g\)
\(n_{Cl_2}=\frac{24,85}{71}=0,35mol\)
\(V_{Cl_2}=0,35.22,4=7,84l\)
5) \(m_{F_2}=53,6-30,8=22,8g\)
\(n_{F_2}=\frac{22,8}{39}=0,6mol\)
\(V_{F_2}=0,6.22,4=13,44l\)

Gọi halogen đó là X , CTTQ: CuX2
\(PTHH:Cu+X_2\underrightarrow{^{to}}CuX_2\)
Áp dụng ĐLTL ta có:
\(\Leftrightarrow\frac{22,4}{5,6}=\frac{64+2X}{33,75}\)
\(\Rightarrow x=35,5\left(Clo\right)\)
Vậy halogen là Clo ( Clo )

Bảo toàn khối lượng ta có: $m_{R}=2,4(g)$$R+X_2\rightarrow RX_2$
Ta có: $\frac{2,4}{R}=\frac{4,26}{2X}$
Lập bảng biện luận thông qua halogen tìm được X và R lần lượt là Cl và Ca
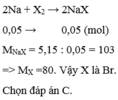
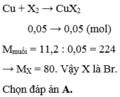
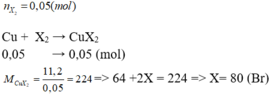
\(X2+nCu-->Cu_nX2\)( n là hóa trị của X nha)
\(n_{X2}=\frac{2,24}{22,4}=0,1\left(mol\right)\)
\(n_{Cu_nX2}=n_{X2}\Rightarrow\frac{22,4}{64n+2X}=0,1\)
\(\Rightarrow22,4=6,4n+0,2X\)
\(\Rightarrow0,2X=22,4-6,4x\)
\(X=\frac{22,4-6,4n}{0,2}\)
\(+n=1\Rightarrow X=80\left(Br\right)\)
Vậy X là Br