Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

mNa2CO3=21,2%.250=53(g) -> nNa2CO3=0,5(mol)
PTHH: CaCl2 + Na2CO3 -> CaCO3 (kt trắng) +2 NaCl
0,5_________0,5_________0,5_____________1(mol)
a) mCaCl2=0,5.111=55,5(g)
=> C%ddCaCl2= (55,5/250).100=22,2%
b) m(kt)=mCaCO3=0,5.100=50(g)

\(MgCl_2+2NaOH\rightarrow Mg\left(OH\right)_2+2NaCl\)
Ta có : \(n_{MgCl_2}=\dfrac{1}{2}n_{NaOH}=\dfrac{1}{2}.\dfrac{150.4\%}{40}=0,075\left(mol\right)\)
=> \(C\%_{MgCl_2}=\dfrac{0,075.95}{100}.100=7,125\%\)
\(n_{Mg\left(OH\right)_2}=\dfrac{1}{2}n_{NaOH}=0,075\left(mol\right)\)
=> \(m_{Mg\left(OH\right)_2}=0,075.58=4,35\left(g\right)\)
Khối lượng của natri hidroxit
C0/0NaOH = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{4.150}{100}=6\left(g\right)\)
Số mol của natri hidroxit
nNaOH = \(\dfrac{m_{NaOH}}{M_{NaOH}}=\dfrac{6}{40}=0,15\left(mol\right)\)
Pt : 2NaOH + MgCl2 → 2NaCl + Mg(OH)2\(|\)
2 1 2 1
0,15 0,075 0,15
Số mol của magie clorua
nMgCl2 = \(\dfrac{0,15.1}{2}=0,075\left(mol\right)\)
Khối lượng của magie clorua
mMgCl2 = nMgCl2 . MMgCl2
= 0,075 . 95
= 7,125 (g)
Nồng độ phần trăm của dung dịch magie clorua
C0/0MgCl2 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{7,125.100}{100}=7,125\left(g\right)\)
b) Số mol của muối natri clorua
nNaCl = \(\dfrac{0,075.2}{1}=0,15\left(mol\right)\)
Khối lượng của muối natri clorua
mNaCl = nNaCl . MNaCl
= 0,15 . 58,5
= 8,775 (g)
Chúc bạn học tốt

a/
\(n_{Na_2O}=\dfrac{9,3}{62}=0,15\left(mol\right)\)
\(Na_2O+H_2O\rightarrow2NaOH\)
0,15 0,3 (mol)
\(m_{NaOH}=0,3.40=12\left(g\right)\)
\(m_A=90,7+9,3=100\left(g\right)\)
\(C\%_{NaOH}=\dfrac{12}{100}.100\%=12\%\)
b/
m\(_{FeSO_4}=\dfrac{16.200}{100}=32\left(g\right)\)
\(\rightarrow m_{FeSO_4}=\dfrac{32}{152}=\dfrac{4}{19}\left(mol\right)\)
\(2NaOH+FeSO_4\rightarrow Na_2SO_4+Fe\left(OH\right)_2\downarrow\)
bđ: 0,3 \(\dfrac{4}{19}\) 0 0 (mol)
pư: 0,3 0,15 0,15 0,15 (mol)
dư: 0 \(\dfrac{23}{380}\) (mol)
\(m_{Fe\left(OH\right)_2}=0,15.90=13,5\left(g\right)\)
\(m_C=100+200-13,5=286,5\left(g\right)\)
\(m_{Na_2SO_4}=0,15.142=21,3\left(g\right)\)
\(\rightarrow C\%_{Na_2SO_4}=\dfrac{21,3}{286,5}.100\%\approx7,4\%\)
\(m_{FeSO_4\left(dư\right)}=\dfrac{23}{380}.152=9,2\left(g\right)\)
\(\rightarrow C\%_{FeSO_4\left(dư\right)}=\dfrac{9,2}{286,5}.100\%\approx3,2\%\)

a, \(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
b, Ta có: \(m_{H_2SO_4}=200.9,8\%=19,6\left(g\right)\)
\(\Rightarrow n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\left(mol\right)\)
Theo PT: \(n_{MgO}=n_{MgSO_4}=n_{H_2SO_4}=0,2\left(mol\right)\)
\(\Rightarrow m_{MgO}=0,2.40=8\left(g\right)\)
c, Ta có: m dd sau pư = 8 + 200 = 208 (g)
\(\Rightarrow C\%_{MgSO_4}=\dfrac{0,2.120}{208}.100\%\approx11,54\%\)
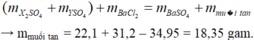
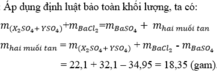
PTHH: \(BaCl_2+Na_2SO_4\rightarrow2NaCl+BaSO_4\downarrow\)
Ta có: \(n_{BaCl_2}=\dfrac{200\cdot13,8\%}{208}=\dfrac{69}{520}\left(mol\right)=n_{Na_2SO_4}=n_{BaSO_4}\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{Na_2SO_4}=\dfrac{\dfrac{69}{520}\cdot142}{250}\cdot100\%\approx7,54\%\\m_{BaSO_4}=\dfrac{69}{520}\cdot233\approx30,92\left(g\right)\end{matrix}\right.\)