Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Cho 19,68 gam hỗn hợp Mg, FeCO3 tác dụng với 1,22 mol NaHSO4 và 0,08 mol Fe(NO3)3 thu được hỗn hợp X chứa NO, N2O và 0,06 mol CO2. Ngoài ra thu được 3,36 gam kim loại không tan là Fe (0,06 mol).
Ta có: ![]()
Do có kim loại không tan nên H+ hết.
Bảo toàn Fe: ![]()
Dung dịch Y sẽ chứa Mg2+ 0,53 mol, Fe2+ 0,08 mol, NH4+, Na+ 1,22 mol, SO42- 1,22 mol và NO3-.
Y tác dụng vừa đủ với 1,26 mol NaOH
![]()
Bảo toàn điện tích: ![]()
![]()
Bảo toàn N:
![]()
Gọi số mol NO và N2O lần lượt là x, y → x+2y=0,12
Bảo toàn e: 0,53.2= 3x + 8y+0,04.8+0,08+0,06.2
Giải hệ: x=0,1; y=0,03 → a=9,158

Đáp án B
Ta có sơ đồ phản ứng:
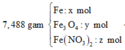
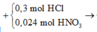

* Y + AgNO3
Bảo toàn nguyên tố Cl:
![]()
![]()
![]()
Fe2+ →Fe3+ + 1e
4H+ + NO−3 + 3e → NO + H2O
0,036 ← 0,027 ← 0,009
Ag+ + 1e → Ag
0,009 ← 0,009
Bảo toàn electron ta có: n F e 2 + = 0,027 + 0,009 = 0,036 mol
Dung dịch Y gồm: Fe2+ : 0,036 mol, H+ : 0,036 mol, Cl− : 0,3 mol, Fe3+
Bảo toàn điện tích ta có:
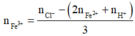
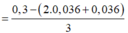
= 0,064 mol
* X + HNO3
n H + p h ả n ứ n g = 0,3 + 0,024 - 0,036 = 0,288 mol
![]()
Bảo toàn nguyên tố oxi ta có: 4b + 6c + 0,024.3 + 0,144 => 2b + 3c = 0,052 (1)
Ta có hệ phương trình:
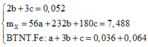
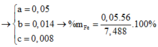
= 37,4 %.

Đáp án B
Phần kết tủa có nAgCl= 0,3 => nAg = 0,009
Bảo toàn electron: nFe2+ = nAg + 3nNO = 0,036
nNO = 0,009 => nH+ dư = 4nNO = 0,036
Đặt a, b, c là số mol Fe, Fe3O4, Fe(NO3)2 trong X
=> mX = 56a + 232b + 180c = 7,488 (1 )
Dung dịch Y còn H+ dư và Fe2+ nên NO3- đã hết.
Vậy Y chứa Fe2+ (0,036), H+ (0,036), Cl- (0,3)
Bảo toàn điện tích => nFe3+ = 0,064
Bảo toàn Fe => a + 3b + c = 0,064 + 0,036 (2)
Bảo toàn H => nH2O = 0,144
Bảo toàn O: 4nFe3O4 + 6nFe(NO3)2 + 3nHNO3 = nZ + nH2O
=> 4b + 6c + 0,024 . 3 = 0,032 + 0,144 (3)
Giải hệ (1)(2)(3):
a = 0,05
b = 0,014
c = 0,008
=> %Fe = 37,4%

Đáp án B
Phương pháp:
Bảo toàn electron
Bảo toàn điện tích
Bảo toàn nguyên tố Fe, O, H
Hướng dẫn giải:
Phần kết tủa có nAgCl= 0,3 => nAg = 0,009
Bảo toàn electron: nFe2+ = nAg + 3nNO = 0,036
nNO = 0,009 => nH+ dư = 4nNO = 0,036
Đặt a, b, c là số mol Fe, Fe3O4, Fe(NO3)2 trong X
=> mX = 56a + 232b + 180c = 7,488 (1 )
Dung dịch Y còn H+ dư và Fe2+ nên NO3- đã hết.
Vậy Y chứa Fe2+ (0,036), H+ (0,036), Cl- (0,3)
Bảo toàn điện tích => nFe3+ = 0,064
Bảo toàn Fe => a + 3b + c = 0,064 + 0,036 (2)
Bảo toàn H => nH2O = 0,144
Bảo toàn O: 4nFe3O4 + 6nFe(NO3)2 + 3nHNO3 = nZ + nH2O
=> 4b + 6c + 0,024 . 3 = 0,032 + 0,144 (3)
Giải hệ (1)(2)(3): a = 0,05 b = 0,014 c = 0,008
=> %Fe = 37,4%

Đáp án D
Đặt a, b, c là số mol Mg, MgCO3 và FeCO3
![]()
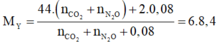
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
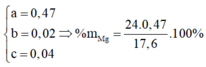
= 64,09%
Gần nhất với giá trị 64,12%
=> Chọn đáp án D.

Đáp án B
Do có sinh ra 0,08 mol H2 nên Fe trong Z là Fe+2 hết và Z chỉ thu được các muối sunfat trung hòa nên H+ hết.
Gọi số mol Mg, MgCO3, FeCO3 lần lượt là a, b, c
=> 24a + 84b + 116c = 17,6
Dựa vào tỉ khối n C O 2 + n H 2 O = 0 , 12 m o l
Cho NaOH vào dung dịch Z, lấy kết tủa nung ngoài không khí được rắn gồm MgO và Fe2O3
=> 40(a+b) + 80c = 22,8
Mặt khác ta có: n C O 2 = b + c → n N 2 O = 0 , 12 - b - c
→ n N H + 4 = 0,16 - 2.(0,12-b-c) = 2b + 2c - 0.08
Bảo toàn H+ phản ứng:
n H + = 1,12 + 0,16 = 0,08.2 + (b+c).2 + 10(0,12 - b - c) + 10(2a + 2b - 0,08)
Giải hệ: a=0,47; b=0,02; c=0,04
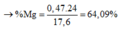

Đáp án D
Do dd Y tác dụng với AgNO3 dư thu được NO nên dd Y chứa Fe2+, Fe3+, Cl-, H+ dư.
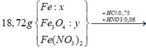
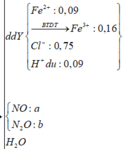
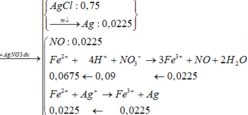
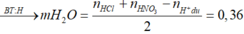
![]()
![]()
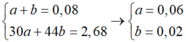
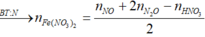
![]()
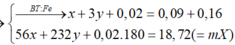
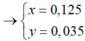
![]()
mFe3O4=0,035.232= 8,12g
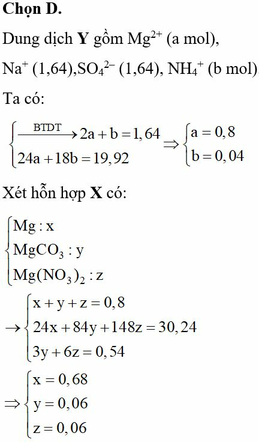
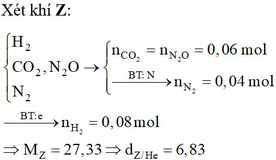

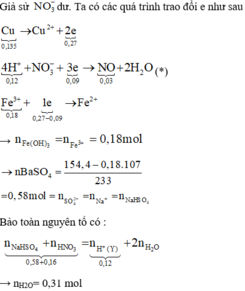


Đáp án B
có: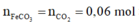
· Dung dịch Y gồm Mg2+ (0,53 mol), Na+ (1,22 mol),