Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(Mg+2HCl\rightarrow MgCl_2+H_2\)
a mol_________________a mol
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
b mol _________________ 1,5b (mol)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
c mol ________________c mol
_ Gọi a,b,c lần lượt là số mol của Mg, Al, Zn (a,b,c > 0)
_ Vì \(m_{h^2}=19,46g\Rightarrow24a+27b+65c=19,46\) (I)
_ Ta có: \(m_{Mg}=m_{Al}\Rightarrow24a=27b\) (II)
_ \(n_{H_2}=\dfrac{16,352}{22,4}=0,73mol\)
\(\Rightarrow a+1,5b+c=0,73\) (III)
Từ (I) (II) (III) => a = 0,27; b = 0,24; c = 0,1
\(\Rightarrow\%m_{Mg}=\%m_{Al}=\dfrac{0,27.24}{19,46}.100\%=33,3\%\)
\(\Rightarrow\%m_{Zn}=33,4\%\)

a) nH2 = 6,72 : 22,4 = 0,3 (MOL)
PTHH:
Zn + 2HCl → ZnCl2 + H2
x x x (mol)
Mg + 2HCl → MgCl2 + H2
y y y (mol)
ta có
65x + 24y = 11,3
x+y=0,3
=> x = 0,1 (mol)
=> y = 0,2 (mol)
=> mMg = 0,2 . 24 = 4,8 (G)
=> %mMg = \(\dfrac{4,8}{11,3}\) . 100% = 42,47 %
=> %mZn = 100% - 42,47% = 57,53 %
Gọi x,y lần lượt là số mol của Zn, Mg
nH2 =\(\dfrac{6,72}{22,4}\)=0,3 mol
Pt: Zn + 2HCl --> ZnCl2 + H2
.....x......................................x
....Mg + 2HCl --> MgCl2 + H2
.....y.......................................y
Ta có hệ pt: {65x+24y=11,3
x+y=0,3
⇔{x=0,1y=0,2
%mZn = 0,1×6511,3.100%=57,5%
%mMg = 0,2×24\11,3.100%=42,5%
Pt: Fe3O4 + 4H2 --to--> 3Fe + 4H2O
0,075 mol<-0,3 mol
mFe3O4 = 0,075 . 232 = 17,4 (g)

Đặt nAl = a (mol)
=> nMg = 2a (mol)
=> 27a + 24 . 2a = 15
=> a = nAl = 0,2 (mol)
nMg = 0,2 . 2 = 0,4 (mol)
mAl = 0,2 . 27 = 5,4 (g)
mMg = 0,4 . 24 = 9,6 (g)
%mAl = \(\dfrac{5,4}{15}=36\%\)
%mMg = 100% - 36% = 64%
PTHH:
2Al + 6HCl -> 2AlCl3 + 3H2
0,2 ---> 0,6 ---------------> 0,3
Mg + 2HCl -> MgCl2 + H2
0,4 ---> 0,8 --------------> 0,4
=> VH2 = (0,3 + 0,4) . 22,4 =15,68 (l)
=> mHCl = (0,6 + 0,8) . 36,5 = 51,1 (g)

a, \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
b, Ta có: 24nMg + 56nFe = 10,4 (1)
Theo PT: \(n_{H_2}=n_{Mg}+n_{Fe}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Mg}=0,2\left(mol\right)\\n_{Fe}=0,1\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,2.24=4,8\left(g\right)\\m_{Fe}=0,1.56=5,6\left(g\right)\end{matrix}\right.\)
c, Theo PT: \(n_{HCl}=2n_{H_2}=0,6\left(mol\right)\Rightarrow V_{ddHCl}=\dfrac{0,6}{0,5}=1,2\left(l\right)\)

a) Mg + 2HCl --> MgCl2 + H2
b) \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
0,3<--0,6<-----------0,3
=> mMg = 0,3.24 = 7,2 (g)
=> mAg = 10,4 - 7,2 = 3,2 (g)
c) \(V_{dd.HCl}=\dfrac{0,6}{0,5}=1,2\left(l\right)\)
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,3 0,3
\(m_{Mg}=0,3\cdot24=7,2g\Rightarrow m_{Ag}=10,4-7,2=3,2g\)
\(n_{HCl}=0,6mol\Rightarrow V_{HCl}=\dfrac{0,6}{0,5}=1,2l\)

a) Mg + 2HCl -> MgCl2 + H2
Al + 3HCl -> AlCl3 + 3/2H2
b) Gọi a, b lần lượt là số mol Mg, Al.
nH2 = 5,6/22,4 = 0,25 (mol)
Mg + 2HCl -> MgCl2 + H2
a 2a a a
Al + 3HCl -> AlCl3 + 3/2H2
b 3b b 3/2b
Ta có hệ pt:
mhh = 24a + 27b = 5,1 (g)
nH2 = a + 3/2b = 0,25 (mol)
=> a = 0,1 (mol)
b = 0,1 (mol)
200 ml = 0,2 l
nHCl = 2a + 3b = 0,2 + 0,3 = 0,5 (mol)
=> CM ddHCl = 0,5/0,2 = 2,5 (M)
%mMg = 24a/5,1*100% = 2,4/5,1*100% = 47,06%
%mAl = 100%-47,06% = 52,94%


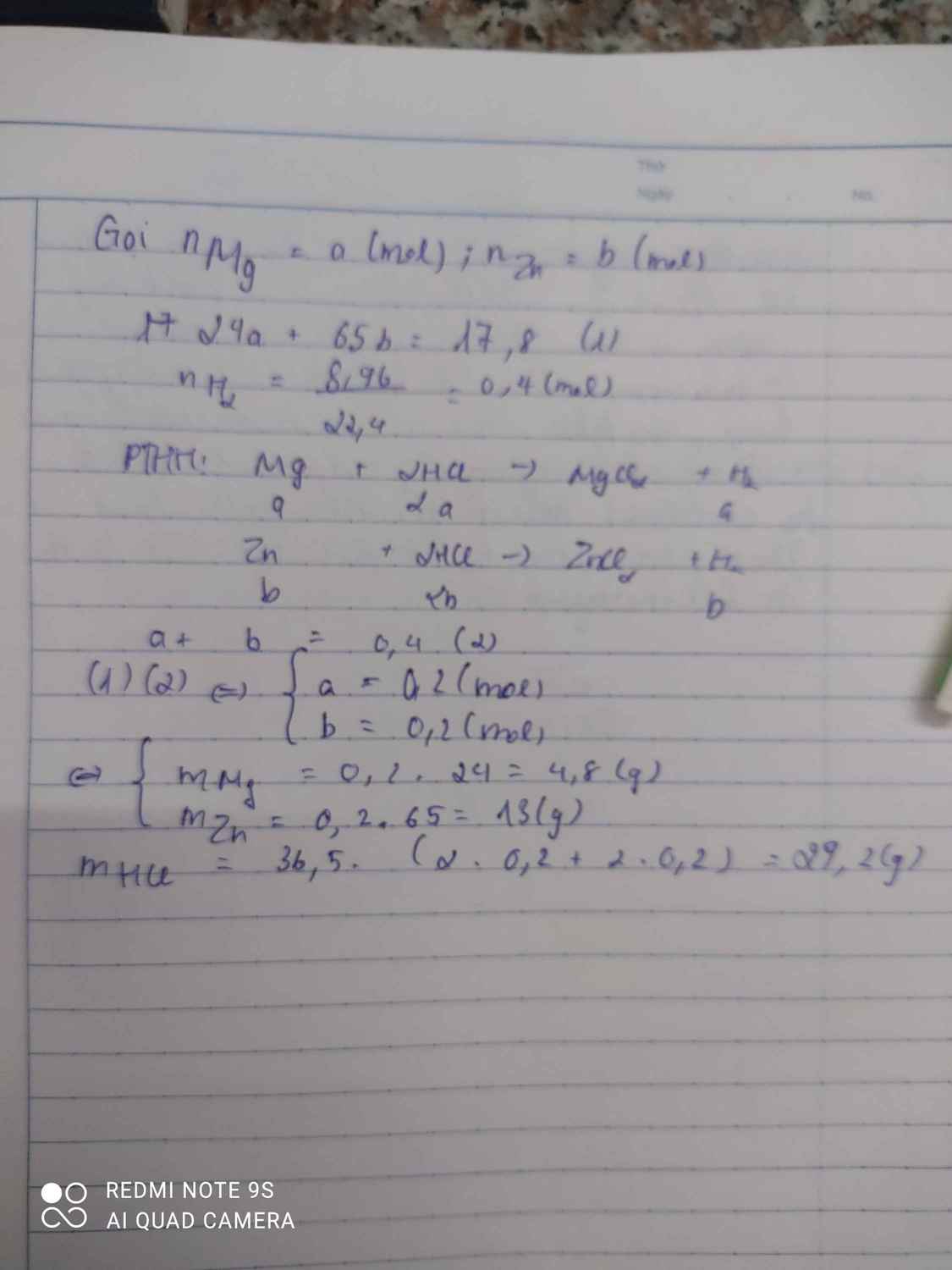
nMg = x; nAl = y; nZn = z
mhh = 24x +27y +65z = 19,46 (1)
Gt: mMg = mAl => 24x = 27y => 24x -27y =0 (2)
nH2 = 16,352/22,4 = 0,73 mol
=> x +3/2.y +z = 0,73 (3)
Từ (1), (2), (3), giải hệ 3 pt 3 ẩn
=> x =0,27; y =0,24; z = 0,1
=> mMg = 24.0,27 = 6,48 = mAl
=> %mMg = %mAl = 6,48.100/19,46= 33,3 %
=> %mZn = 100% - 2.33,3% = 33,4%
Bạn giải dùm mình câu b với