Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Xét trường hợp 20,4 gam A tác dụng với dung dịch HCl dư:
Gọi số mol các chất là Al: a mol; Zn: b mol; Fe: c mol
Ta có:

Các quá trình nhường, nhận electron:
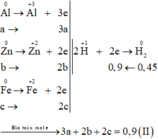
Xét trường hợp 0,2 mol A tác dụng với Cl2:
Gọi số mol các chất là Al: ka mol; Zn: kb mol; Fe: kc mol
Ta có:
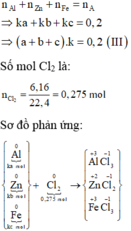
Các quá trình nhường, nhận electron:
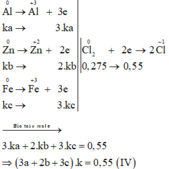
Lấy (IV) chia (III) vế với vế ta được:


Câu 1 :
\(n_{H2}=\dfrac{5,04}{22,4}=0,225\left(mol\right)\)
Pt : \(2Al+6HCl\rightarrow2AlCl_3+3H_2|\)
2 6 2 3
a 0,15 1,5a
\(Zn+2HCl\rightarrow ZnCl_2+H_2|\)
1 2 1 1
b 0,3 1b
a) Gọi a là số mol của Al
b là số mol của Zn
\(m_{Al}+m_{Zn}=11,1\left(g\right)\)
⇒ \(n_{Al}.M_{Al}+n_{Zn}.M_{Zn}=11,1g\)
⇒ 27a + 65b = 11,1g(1)
Theo phương trình : 1,5a + 1b = 0,225(2)
Từ(1),(2), ta có hệ phương trình :
27a + 65b = 11,1g
1,5a + 1b = 0,225
⇒ \(\left\{{}\begin{matrix}a=0,05\\b=0,15\end{matrix}\right.\)
\(m_{Al}=0,05.27=1,35\left(g\right)\)
\(m_{Zn}=0,15.65=9,75\left(g\right)\)
0/0Al = \(\dfrac{1,35.100}{11,1}=12,16\)0/0
0/0Zn = \(\dfrac{9,75.100}{11,1}=87,84\)0/0
b) \(n_{HCl\left(tổng\right)}=0,15+0,3=0,45\left(mol\right)\)
\(V_{ddHCl}=\dfrac{0,45}{1}=0,45\left(l\right)\)
Chúc bạn học tốt
Câu 2 :
\(n_{H2}=\dfrac{1,456}{22,4}=0,065\left(mol\right)\)
Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
a 0,1 1a
\(2Al+6HCl\rightarrow2AlCl_3+3H_2|\)
2 6 2 3
b 0,03 1,5b
a) Gọi a là số mol của Fe
b là số mol của Al
\(m_{Fe}+m_{Al}=3,07\left(g\right)\)
⇒ \(n_{Fe}.M_{Fe}+n_{Al}.M_{Al}=3,07g\)
⇒ 56a + 27b = 3,07g(1)
Theo phương trình : 1a + 1,5b = 0,065(2)
Từ(1),(2),ta có hệ phương trình :
56a + 27b = 3,07g
1a + 1,5b = 0,065
⇒ \(\left\{{}\begin{matrix}a=0,05\\b=0,01\end{matrix}\right.\)
\(m_{Fe}=0,05.56=2,8\left(g\right)\)
\(m_{Al}=0,01.27=0,27\left(g\right)\)
0/0Fe = \(\dfrac{2,8.100}{3,07}=91,21\)0/0
0/0Al = \(\dfrac{0,27.100}{3,07}=8,79\)0/0
b) \(n_{HCl\left(tổng\right)}=0,1+0,03=0,13\left(mol\right)\)
\(m_{HCl}=0,13.36,5=4,745\left(g\right)\)
\(m_{ddHCl}=\dfrac{4,745.100}{10}=47.45\left(g\right)\)
Chúc bạn học tốt

Chọn đáp án A
n H 2 = 8 , 96 22 , 4 = 0 , 4 m o l
Bảo toàn electron
3 n A l + 2 n M g = 2 n H 2 ⇒ 3 n A l + 2 n M g = 0 , 8 1 m h h = 27 n A l + 24 n M g = 7 , 8 2
Giải hệ (1) và (2)
n A l = 0 , 2 m o l , n M g = 0 , 1 m o l ⇒ % m A l = 0 , 2 . 27 7 , 8 . 100 % = 69 , 23 %

Xét P2 : Chỉ có Al phản ứng với NaOH => nAl.3 = 2nH\(_2\) ( Bảo toàn e)
=> nAl = 0,1 mol
Xét P1 : Fe và Al phản ứng với HCl đặc => 2nFe + 3nAl = 2nH\(_2\)
=> nFe = 0,1 mol
=> Trong mỗi phần thì có : mCu = \(\dfrac{1}{2}.10-27.0,1-56.0,1=1,7\left(g\right)\)
\(\%m_{Cu\left(X\right)}=\%m_{Cu\left(1/2X\right)}=17\%\)

Ta có: 56nFe + 27nAl = 8,3 (1)
\(n_{SO_2}=\dfrac{7,427}{24,79}=0,3\left(mol\right)\)
Theo ĐLBT e, có: 3nFe + 3nAl = 2nSO2 = 0,6 (2)
Từ (1) và (2) ⇒ nFe = nAl = 0,1 (mol)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,1.56}{8,3}.100\%\approx67,47\%\\\%m_{Al}\approx32,53\%\end{matrix}\right.\)

\(n_{PbS}=\dfrac{47,8}{239}=0,2\left(mol\right)\)
Bảo toàn S: \(n_{FeS}=n_{H_2S}=0,2\left(mol\right)\)
\(n_{H_2}=\dfrac{6,72}{22,4}-0,2=0,1\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,1<----------------------0,1
=> mFe = 0,1.56 = 5,6 (g)
mFeS = 0,2.88 = 17,6 (g)
\(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{5,6}{5,6+17,6}.100\%=24,138\%\\\%m_{FeS}=\dfrac{17,6}{5,6+17,6}.100\%=75,862\%\end{matrix}\right.\)

Bài 1: Sửa đề: 1,53g hỗn hợp 2 kim loại
Khí sinh ra: H2
Gọi nAl = x, nMg = y
=> 27x + 24y = 1,53 (1)
Bảo toàn e
3x + 2y = 2.\(\dfrac{1,68}{22,4}=0,15mol\)(2)
Từ (1) + (2) => x = 0,03, y = 0,03
%mAl = \(\dfrac{0,03.27}{1,53}.100\%=52,94\%\)
%mMg = 47,06%

\(n_{H_2} = \dfrac{6,72}{22,4} = 0,3(mol)\\ Mg + 2HCl \to MgCl_2 + H_2\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\)
\(\left\{{}\begin{matrix}Mg:x\left(mol\right)\\Al:y\left(mol\right)\end{matrix}\right.\)→ \(\left\{{}\begin{matrix}24x+27y=6,3\\x+1,5y=0,3\end{matrix}\right.\)→ \(\left\{{}\begin{matrix}x=0,15\\y=0,1\end{matrix}\right.\)
Vậy :
\(\%m_{Mg} = \dfrac{0,15.24}{6,3}.100\% = 57,14\%\)

a)\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Mol: x 1,5x
PTHH: Mg + H2SO4 → MgSO4 + H2
Mol: y y
Ta có: \(\left\{{}\begin{matrix}27x+24y=5,1\\1,5x+y=0,25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
\(\%m_{Al}=\dfrac{0,1.27.100\%}{5,1}=52,94\%;\%m_{Mg}=100-52,94=47,06\%\)
b)
PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Mol: 0,1 0,15 0,05
PTHH: Mg + H2SO4 → MgSO4 + H2
Mol: 0,1 0,1 0,1
\(m_{ddH_2SO_4}=\dfrac{\left(0,1+0,15\right).98.100}{9,8}=250\left(g\right)\)
mdd sau pứ = 5,1+250-0,15.2 = 254,8(g)
\(C\%_{ddAl_2\left(SO_4\right)_3}=\dfrac{0,05.342.100\%}{254,8}=6,71\%\)
\(C\%_{ddMgSO_4}=\dfrac{0,1.120.100\%}{254,8}=4,71\%\)
Gọi : \(\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\)⇒ 56x + 27y = 13,7(1)
\(Fe + 2HCl \to FeCl_2 + H_2\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\)
Theo PTHH :
\(n_{H_2} = x + 1,5y = \dfrac{24,64}{22,4} = 1,1(2)\)
Từ (1)(2) suy ra : x = -0,16<0
(Sai đề)