Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cl2 + 2KOH ---> KCl + KClO + H2O
nCl2 = 0,6 mol; nKCl = 0,5 mol.
Số mol KOH = 2nKCl = 1,0 mol. Nên nồng độ KOH = 1/2,5 = 0,4M.

Ta có :
\(n_{Cl2}=\frac{1,456}{22,4}=0,065\left(mol\right)\)
\(n_{KCl}=\frac{37,25}{74,5}=0,5\left(mol\right)\)
\(PTHH:3Cl_2+6KOH\rightarrow5KCl+KClO_3+3H_2O\)
_______0,065___0,13 ______________
\(\Rightarrow CM_{dd\left(KOH\right)}=\frac{0,13}{0,5}=0,26M\)

nNaOH = 1.2,5 = 2,5 (mol)
\(n_{Cl_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
PTHH: 2NaOH + Cl2 --> NaCl + NaClO + H2O
Xét tỉ lệ: \(\dfrac{2,5}{2}>\dfrac{0,6}{1}\) => NaOH dư, Cl2 hết
PTHH: 2NaOH + Cl2 --> NaCl + NaClO + H2O
1,2<---0,6
=> \(C_{M\left(NaOH.sau.pư\right)}=\dfrac{2,5-1,2}{2,5}=0,52M\)
=> A
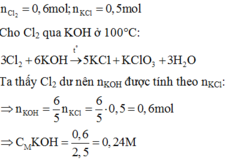
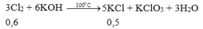



Đáp án B
nCl2 = 0,6 mol, nKCl = 0,5 mol
Phản ứng với KOH ở 100 độ C:
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
0,6 mol 0,5 mol
Từ PT ⇒ Cl2 dư nên số mol KOH tính theo số mol KCl
⇒ nKOH = 0,6 mol ⇒ CM(KOH)= 0,24 M