Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 1:
a, \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Cu}=\dfrac{6,4}{64}=0,1\left(mol\right)\)
Theo PT: \(n_{CuO}=n_{Cu}=0,1\left(mol\right)\Rightarrow m_{CuO}=0,1.80=8\left(g\right)\)
\(\Rightarrow m_{Fe_2O_3}=32-m_{CuO}=24\left(g\right)\)
Bài 2:
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\), \(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PT: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Xét tỉ lệ: \(\dfrac{0,1}{2}< \dfrac{0,3}{1}\), ta được O2 dư.
Theo PT: \(n_{H_2O}=n_{H_2}=0,1\left(mol\right)\Rightarrow m_{H_2O}=0,1.18=1,8\left(g\right)\)
bài 1
a)PTHH:CuO+H2➞Cu+H2O
PTHH:Fe2O3+3H2➞2Fe+3H2O
b)nCuO=\(\dfrac{32}{80}\)=0,4(m)
nCu=\(\dfrac{6,4}{64}\)=0,1(m)
PTHH : CuO + H2 ➞ Cu + H2O
tỉ lệ :1 1 1 1
số mol
ban đầu:0,4 0,1
ta có tỉ lệ:\(\dfrac{0,4}{1}\)>\(\dfrac{0,1}{1}\)=>CuO dư
PTHH : CuO + H2 ➞ Cu + H2
số mol:0,1 0,1 0,1 0,1
m\(_{CuO}\)=0,1.80=8(g)
bài 2
n\(_{H_2}\)=\(\dfrac{2,24}{22,4}\)=0,1(m)
n\(_{O_2}\)=\(\dfrac{6,72}{22,4}\)=0,3(m)
PTHH : 2H2 + O2 ➞ 2H2O
tỉ lệ : 2 1 2
số mol
ban đầu:0,1 0,3
ta có tỉ lệ:\(\dfrac{0,1}{2}\)<\(\dfrac{0,3}{1}\)=>O2 dư
PTHH : 2H2 + O2 ➞ 2H2O
tỉ lệ :2 1 2
số mol:0,1 0,05 0,1
m\(_{H_2O}\)=0,1.18=1,8(g)

\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\a, PTHH:4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ Vì:\dfrac{0,2}{4}< \dfrac{0,2}{3}\Rightarrow O_2dư\\ \Rightarrow n_{O_2\left(dư\right)}=0,2-\dfrac{3}{4}.0,2=0,05\left(mol\right)\\ \Rightarrow m_{O_2\left(dư\right)}=0,05.32=1,6\left(g\right)\\ b,n_{Al_2O_3}=\dfrac{n_{Al}}{2}=\dfrac{0,2}{2}=0,1\left(mol\right)\\ \Rightarrow m_{Al_2O_3}=102.0,1=10,2\left(g\right)\)
a, Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
\(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PT: \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
Xét tỉ lệ: \(\dfrac{0,2}{4}< \dfrac{0,2}{3}\), ta được O2 dư.
Theo PT: \(n_{O_2\left(pư\right)}=\dfrac{3}{4}n_{Al}=0,15\left(mol\right)\)
\(\Rightarrow n_{O_2\left(dư\right)}=0,05\left(mol\right)\)
\(\Rightarrow m_{O_2\left(dư\right)}=0,05.32=1,6\left(g\right)\)
b, Theo PT: \(n_{Al_2O_3}=\dfrac{1}{2}n_{Al}=0,1\left(mol\right)\)
\(\Rightarrow m_{Al_2O_3}=0,1.102=10,2\left(g\right)\)
Bạn tham khảo nhé!

a. \(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
\(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH : 2Mg + O2 -> 2MgO
0,2 0,1 0,2
Xét tỉ lệ : \(\dfrac{0,2}{2}< \dfrac{0,3}{1}\) => Mg đủ , O2 dư
\(m_{O_2\left(dư\right)}=\left(0,3-0,1\right).32=6,4\left(g\right)\)
b) \(m_{MgO}=0,2.40=8\left(g\right)\)

Theo gt ta có: $n_{Zn}=0,1(mol);n_{CuO}=0,25(mol)$
a, $Zn+2HCl\rightarrow ZnCl_2+H_2$
$CuO+H_2\rightarrow Cu+H_2O$
b, Ta có: $n_{ZnCl_2}=0,1(mol)\Rightarrow m_{ZnCl_2}=13,6(g)$
b, Ta có: $n_{H_2}=0,1(mol)$
Sau phản ứng chất còn dư là CuO dư 0,15 mol
$\Rightarrow m_{CuO/du}=12(g)$
a)
$Zn + 2HCl \to ZnCl_2 + H_2$
$CuO + H_2 \xrightarrow{t^o} Cu + H_2O$
b)
n ZnCl2 = n Zn = 6,5/65 = 0,1(mol)
=> m ZnCl2 = 0,2.136 = 13,6(gam)
c) n H2 = n Zn = 0,1 mol
CuO + H2 --to--> Cu + H2O
n CuO = 20/80 = 0,25 > n H2 = 0,1 nên CuO dư
n CuO pư = n H2 = 0,1 mol
=> m CuO dư = 20 - 0,1.80 = 12(gam)

a)nO2=\(\dfrac{3.36}{22.4}\)=0,15(mol)
2KMnO4(to)→K2MnO4+MnO2+O2
Theo PT: nKMnO4=2nO2=0,3(mol)
→m=mKMnO4=0,3.158=47,4(g)
b)nH2=\(\dfrac{8.96}{22.4}\)=0,4(mol)
2H2+O2(to)→2H2O
Vì \(\dfrac{nH_2}{2}\)<nO2→O2nH2 dư
Theo PT: nH2O=nH2=0,4(mol)
→mH2O=0,4.18=7,2(g)

a, PT: \(2Zn+O_2\underrightarrow{t^o}2ZnO\) - pư hóa hợp.
b, \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{Zn}=0,1\left(mol\right)\Rightarrow V_{O_2}=0,1.22,4=2,24\left(l\right)\)
c, \(n_{H_2SO_4}=\dfrac{9,8}{98}=0,1\left(mol\right)\)
PT: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,1}{1}\), ta được Zn dư.
Theo PT: \(n_{H_2}=n_{H_2SO_4}=0,1\left(mol\right)\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
\(n_{ZnSO_4}=n_{H_2SO_4}=0,1\left(mol\right)\Rightarrow m_{ZnSO_4}=0,1.161=16,1\left(g\right)\)

Câu 2:
\(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: \(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\)
0,6<------------------------------------0,3
\(\Rightarrow m_{KMnO_4}=0,6.158=94,8\left(g\right)\)
Câu 3:
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2<-----------------------0,2
=> mZn = 0,2.65 = 13 (g)
Câu 4:
\(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\)
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,4------------------------->0,4
\(CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\)
0,4<---0,4
\(\Rightarrow m_{CuO}=0,4.80=32\left(g\right)\)
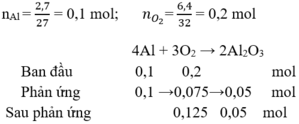


\(2Zn+O_2\underrightarrow{t^o}2ZnO\)
a/ \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
\(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Lập tỉ lệ :
\(\dfrac{n_{Zn}}{2}< n_{O_2}\)
=> \(O_2\) dư , Zn phản ứng hết
b/ \(n_{ZnO}=n_{Zn}=0,2\left(mol\right)\)
=> \(m_{ZnO}=16,2\left(g\right)\)
c/ Cần bổ sung Zn để phản ứng xảy ra hoàn toàn