Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
$Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + H_2O$
$2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O$
b) n Cu =a (mol) ; n Fe = b(mol)
=> 64a + 56b = 12(1)
n SO2 = a + 1,5b = 5,6/22,4 = 0,25(2)
(1)(2) suy ra a = b = 0,1
%m Cu = 0,1.64/12 .100% = 53,33%
%m Fe = 100% -53,33% = 46,67%
c)
n CuSO4 = a = 0,1(mol)
n Fe2(SO4)3 = 0,5a = 0,05(mol)
m muối = 0,1.160 + 0,05.400 = 36(gam)
d) n H2SO4 = 2n SO2 = 0,5(mol)
V H2SO4 = 0,5/2 = 0,25(lít)

a) n Fe = a(mol) ; n Cu = b(mol)
=> 56a + 64b = 4,8(1)
n SO2 = 2,24/22,4 = 0,1(mol)
Bảo toàn e :
3n Fe + 2n Cu = 2n SO2
<=> 3a + 2b = 0,2(2)
Từ (1)(2) suy ra a = b = 0,04
%m Fe = 0,04.56/4,8 .100% = 46,67%
%m Cu = 100% -46,67% = 53,33%
b)
n KOH = 0,15
Ta có :
1 < n KOH / n SO2 = 0,15/0,1 = 1,5 < 2 nên muối sinh ra là Na2SO3(x mol) và NaHSO3(y mol)
2NaOH + SO2 $\to$ Na2SO3 + H2O
NaOH + SO2 $\to$ NaHSO3
Theo PTHH :
n SO2 = a + b = 0,1
n NaOH = 2a + b = 0,15
Suy ra a= 0,05 ; b = 0,05
m muối = 0,05.126 + 0,05.104 = 11,5 gam
Bài 2 :
- Gọi số mol Fe và Cu lần lượt là a, b mol
Ta có : mhh = mFe + mCu = 56a + 64b = 4,8
Bte : 3a + 2b = 0,2
=> a = b =0,04mol
a, Ta có : mFe =n.M = 2,24g ( 46,7% )
=> %Cu = 53,3%
b, Ta thấy sau phản ứng thu được K+, SO3-2 xmol, HSO3- y mol
BtS : x + y = 0,1
BTĐT : 2x + y = 0,15
=> x =y = 0,05 mol
=> mM = mK2SO3 + mKHSO3 = 13,9g

`2Fe + 6H_2 SO_[4(đ,n)] -> Fe_2(SO_4)_3 + 6H_2 O + 3SO_2 \uparrow`
`0,1` `0,15` `(mol)`
`2Ag + 2H_2 SO_[4(đ,n)] -> Ag_2 SO_4 + 2H_2 O + SO_2 \uparrow`
`0,2` `0,1` `(mol)`
`n_[SO_2]=[5,6]/[22,4]=0,25(mol)`
Gọi `n_[Fe]=x` ; `n_[Ag]=y`
`=>` $\left[\begin{matrix} 56x+108y=27,2\\ \dfrac{3}{2}x+\dfrac{1}{2}y=0,25\end{matrix}\right.$
`<=>` $\left[\begin{matrix} x=0,1\\ y=0,2\end{matrix}\right.$
`a)%m_[Fe]=[0,1.56]/[27,2] .100~~20,59%`
`=>%m_[Ag]~~100-20,59~~79,41%`
`b)n_[SO_2]=0,15+0,1=0,25(mol)`
`n_[NaOH]=0,5.0,8=0,4(mol)`
Ta có:`T=[0,4]/[0,25]=1,6 ->` Tạo muối `Na_2 SO_3` và `NaHSO_3`
`SO_2 + 2NaOH -> Na_2 SO_3 + H_2 O`
`SO_2 + NaOH -> NaHSO_3`
Gọi `n_[Na_2 SO_3]=x ; n_[NaHSO_3]=y`
`=>` $\left[\begin{matrix} x+y=0,25\\ 2x+y=0,4\end{matrix}\right.$
`<=>` $\left[\begin{matrix} x=0,15\\ y=0,1\end{matrix}\right.$
`=>C_[M_[Na_2 SO_3]]=[0,15]/[0,5]=0,3(M)`
`=>C_[M_[NaHSO_3]]=[0,1]/[0,5]=0,2(M)`
Lần sau chú ý dùng dấu \(\left\{{}\begin{matrix}\\\end{matrix}\right.\) ha, dấu \(\left[{}\begin{matrix}\\\end{matrix}\right.\) có ý nghĩa là xảy ra một trong các trường hợp còn dấu \(\left\{{}\begin{matrix}\\\end{matrix}\right.\) có ý nghĩa là đồng thời xảy ra

Đáp án C.
Kim loại không phản ứng với H2SO4 loãng là Cu.
Gọi nCu = x, nMg = y, nAl = z
Ta có:
64x + 24y + 27z = 33,2 (1)
Bảo toàn e:
2nMg + 3nAl = 2nH2
=> 2y + 3z = 2.1 (2)
2nCu = 2nSO2 => x = 0.2 (mol) (3)
Từ 1, 2, 3 => x = 0,2; y = z = 0,4 (mol)
mCu = 0,2.64 = 12,8 (g)
mMg = 0,4.24 = 9,6 (g)
mAl = 10,8 (g)

Các PTHH :
2Al + 3 H 2 SO 4 → Al 2 SO 4 3 + 3 H 2 (1)
2Al + 6 H 2 SO 4 → Al 2 SO 4 3 + 3 SO 2 + 6 H 2 O (2)
Cu + 2 H 2 SO 4 → Cu SO 4 + 2 H 2 O + SO 2 (3)
Theo PTHH (1) số mol Al tham gia phản ứng bằng 2/3 số mol H 2 => Khối lượng AI trong hỗn hợp : 2×2/3×0,06×27 = 2,16(g)
Số mol SO 2 được giải phóng bởi Al: 2,16/27 x 3/2 = 0,12 mol
Theo PTHH (2) và (3) số mol SO 2 giải phóng bởi Cu : 2.0,1 - 0,12 = 0,08 (mol)
Theo PTHH (3) khối lượng Cu trong hỗn hợp : 0,08. 64 = 5,12 (g)
Vậy m = 2,16 + 5,12 = 7,28 (g).

Đáp án B
nSO2 = 1,7 (mol)
Chất rắn Z là Fe2O3, nFe2O3 = 0,4 (mol)
2Febđ → Fe2O3
0,8 ← 0,4 (mol)
Ta có: mX = 1,7 ×64 – 48=60,8 (gam)
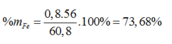

1) Đặt \(\left\{{}\begin{matrix}n_{Cu}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow64a+56b=18,4\) (1)
Ta có: \(n_{SO_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
Bảo toàn electron: \(2a+3b=0,35\cdot2=0,7\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Cu}=\dfrac{0,2\cdot64}{18,4}\cdot100\%\approx69,57\%\\\%m_{Fe}=30,43\%\end{matrix}\right.\)
2) PTHH: \(NaOH+SO_2\rightarrow NaHSO_3\)
Theo PTHH: \(n_{NaOH}=n_{SO_2}=0,35\left(mol\right)\) \(\Rightarrow V_{NaOH}=\dfrac{0,35}{2}=0,175\left(l\right)=175\left(ml\right)\)

\(1) n_{Cu} = a(mol) ; n_{Fe} = b(mol) \Rightarrow 64a + 56b = 18,4(1)\\ n_{SO_2} = \dfrac{7,84}{22,4} = 0,35(mol)\)
Bảo toàn electron :
\(2a + 3b = 0,35.2(2)\\ (1)(2) \Rightarrow a = 0,2 ; b = 0,1\\ \%m_{Cu} = \dfrac{0,2.64}{18,4}.100\% = 69,57\%\\ \%m_{Fe} = 100\%-69,57\% = 30,43\%\\ 2) NaOH + SO_2 \to NaHSO_3\\ n_{NaOH} = n_{SO_2} = 0,35(mol)\\ \Rightarrow V_{dd\ NaOH} = \dfrac{0,35}{2} = 0,175(lít)\)


a) Các PTHH:
Thí nghiệm 1: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\left(1\right)\)
Tỉ lệ mol: \(1----------->1\)
Thí nghiệm 2: \(Cu+2H_2SO_4\rightarrow CuSO_4+SO_2+2H_2O\left(2\right)\)
Tỉ lệ mol: \(1------------>1\)
Thí nghiệm 3: \(SO_2+Ca\left(OH\right)_2\left(dư\right)\rightarrow CaSO_3\downarrow+H_2O\left(3\right)\)
Tỉ lệ mol: \(1----------->1\)
b) Theo đề: \(n_{H_2}=\frac{2,24}{22,4}=0,1\left(mol\right)\)
Từ (1) \(\Rightarrow n_{Fe}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,1.56=5,6\left(g\right)\)
\(\Rightarrow\%m_{Fe}=\frac{5,6}{12}.100\%=46,67\%\)
\(\Rightarrow\%m_{Cu}=100\%-46,67\%=53,33\%\)
c) Ta có: \(m_{Cu}=12-5,6=6,4\left(g\right)\Rightarrow n_{Cu}=\frac{6,4}{64}=0,1\left(mol\right)\)
Theo (2), ta có: \(n_{SO_2}=n_{Cu}=0,1\left(mol\right)\)
Theo (3), ta có: \(n_{CaSO_3}=n_{SO_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{CaSO_3}=a=0,1.120=12\left(g\right)\)
j