Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nC2H5OH = 8.05/46 = 0.175 (mol)
nCH3COOH = 36/60 = 0.6 (mol)
nCH3COOC2H5 = 12.32/88 = 0.14 (mol)
C2H5OH + CH3COOH <-H2SO4đ,t0-> CH3COOC2H5 + H2O
1.......................1
0.175................0.6
LTL : 0.175/1 < 0.6/1
=> CH3COOH dư
mCH3COOH (dư) = ( 0.6 - 0.175) * 60 = 25.5 (g)
nCH3COOC2H5 = nC2H5OH = 0.175 (mol)
H% = 0.14/0.175 * 100% = 80%

a, PT: \(CH_3COOH+C_2H_5OH\underrightarrow{_{H_2SO_{4\left(đ\right)}}}CH_3COOC_2H_5+H_2O\)
b, Ta có: \(n_{CH_3COOH}=\dfrac{30}{60}=0,5\left(mol\right)\)
\(n_{C_2H_5OH}=\dfrac{27,6}{46}=0,6\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,5}{1}< \dfrac{0,6}{1}\), ta được C2H5OH.
Theo PT: \(n_{CH_3COOC_2H_5\left(LT\right)}=n_{CH_3COOH}=0,5\left(mol\right)\)
\(\Rightarrow m_{CH_3COOC_2H_5\left(LT\right)}=0,5.88=44\left(g\right)\)
Mà: m CH3COOC2H5 (TT) = 35,2 (g)
\(\Rightarrow H\%=\dfrac{35,2}{44}.100\%=80\%\)
Bạn tham khảo nhé!

\(n_{CH_3COOH}=\dfrac{30}{60}=0,5\left(mol\right)\)
\(n_{C_2H_5OH}=\dfrac{27,6}{46}=0,6\left(mol\right)\)
PT: \(CH_3COOH+C_2H_5OH⇌CH_3COOC_2H_5+H_2O\) (xt: H2SO4 đặc, to)
Xét tỉ lệ: \(\dfrac{0,5}{1}< \dfrac{0,6}{1}\), ta được C2H5OH dư nếu pư hết.
Theo PT: \(n_{CH_3COOC_2H_5\left(LT\right)}=n_{CH_3COOH}=0,5\left(mol\right)\)
\(\Rightarrow m_{CH_3COOC_2H_5\left(LT\right)}=0,5.88=44\left(g\right)\)
\(\Rightarrow H=\dfrac{26,4}{44}.100\%=60\%\)

Đáp án: C
PTHH: C H 3 C O O H + C 2 H 5 O H ⇄ H 2 S O 4 , t 0 C H 3 - C O O C 2 H 5 + H 2 O
Theo PTHH, vì lượng C 2 H 5 O H dư nên lượng C H 3 C O O C 2 H 5 theo lí thuyết phải tính theo lượng C H 3 C O O H .
Theo lí thuyết số mol C H 3 C O O H phản ứng là 1 mol
=> khối lượng C H 3 C O O C 2 H 5 thu được theo lí thuyết = 1.88 = 88 gam
Thực tế chỉ thu được 55 gam
=> hiệu suất phản ứng H = 55 88 . 100 % = 62 , 5 %
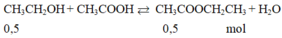
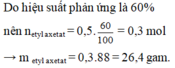

$CH_3COOH + CH_3CH_2OH \buildrel{{H_2SO_4,t^o}}\over\rightleftharpoons CH_3COOCH_2CH_3 + H_2O$
n CH3COOH = 12/60 = 0,2 < n CH3CH2OH = 23/46 = 0,5 nên hiệu suất tính theo số mol của CH3COOH
Theo PTHH :
n CH3COOH = n CH3COOCH2CH3 = 14,08/88 = 0,16(mol)
=> H = 0,16/0,2 .100% = 80%