Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1) \(\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{1,68}{6,72}\cdot100\%=25\%\\\%V_{C_2H_2}=75\%\end{matrix}\right.\)
2) Ta có: \(n_{C_2H_4}=\dfrac{5,6}{28}=0,2\left(mol\right)\)
\(\Rightarrow\%V_{C_2H_4}=\dfrac{0,2}{\dfrac{5,6}{22,4}}\cdot100\%=80\%\) \(\Rightarrow\%V_{CH_{_4}}=20\%\)

a) Các phương trình phản ứng:
C2H4 + Br2 → C2H4Br2
C2H2 + 2Br2 → C2H2Br4
C2H2 + Ag2O → C2Ag2 + H2O
Hay
C2H2 + 2AgNO3 + 2NH3 → C2Ag2 + 2NH4NO3
b) Gọi a, b, c lần lượt là số mol của CH4, C2H4, C2H2 trong 4,3gam hỗn hợp T.
– Số mol Br2 = 0,15 (mol); số mol kết tủa = số mol C2H2 = 0,075 (mol); số mol T = 0,3 (mol). Do đó nT = 4nC2H2
– Ta có hệ phương trình:
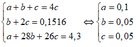
– Suy ra % thể tích mỗi khí trong T:
%VCH4 = 50%; %VC2H2 = %VC2H4 = 25%

\(n_{hh}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
\(n_{Br_2}=\dfrac{8}{160}=0,05\left(mol\right)\)
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
0,05 0,05 ( mol )
\(\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,05}{0,5}.100=10\%\\\%V_{CH_4}=100\%-10\%=90\%\end{matrix}\right.\)
--> Chọn B

Ta có: \(n_{Br_2}=\dfrac{1,6}{160}=0,01\left(mol\right)\)
PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Theo PT: \(n_{C_2H_4}=n_{Br_2}=0,01\left(mol\right)\)
\(\Rightarrow\%V_{C_2H_4}=\dfrac{0,01.22,4}{0,5}.100\%=44,8\%\)
\(\Rightarrow\%V_{CH_4}=100-44,8=55,2\%\)
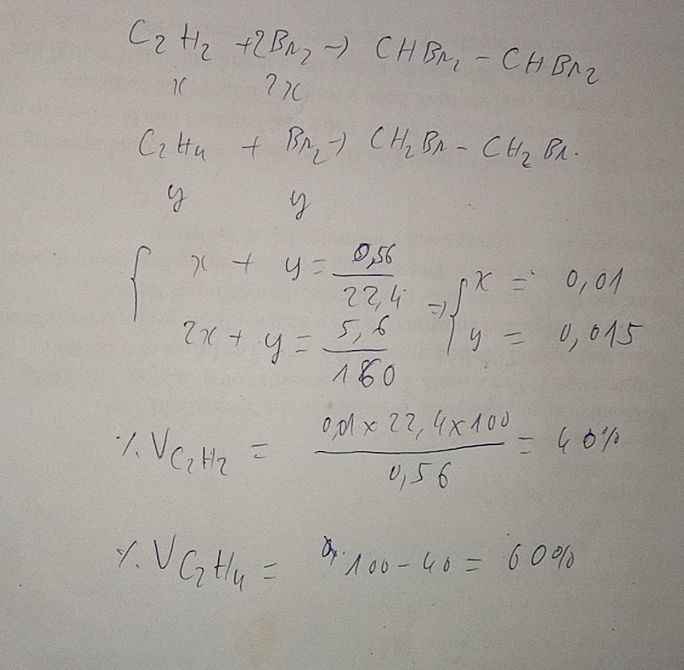

\(n_{Br_2}=\dfrac{16}{160}=0,1mol\\ C_2H_4+Br_2\xrightarrow[]{}C_2H_4Br_2\\ n_{C_2H_4}=n_{Br_2}=0,1mol\\ V_{C_2H_4}=0,2.22,4=4,48l\\ V_{CH_4}=11,2-4,48=6,72l\)