Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án B
n C l 2 = x mol; n O 2 = y mol
⇒ x + y = 0,35 mol (1)
Áp dụng định luật bảo toàn khối lượng: m C l 2 + m O 2 = m Z – m Y = 19g
⇒ 71x + 32y = 19 (2)
Từ (1)(2) => x = 0,2; y = 0,15
Đặt n M g = a mol; n A l = b mol
⇒ 24a + 27b = 11,1g (3)
Bảo toàn e: 2 n M g + 3 n A l = 2 n C l 2 + 4 n O 2
⇒ 2a +3b = 1 (4)
Từ (3)(4) ⇒ a = 0,35; b = 0,1
⇒% m A l = 0 , 1 . 27 11 , 1 . 100 % = 23 , 32 %

- Từ giả thiết tính được : n Cl 2 = 0,035 mol; n O 2 = 0,025 mol
Theo ĐLBT khối lượng :
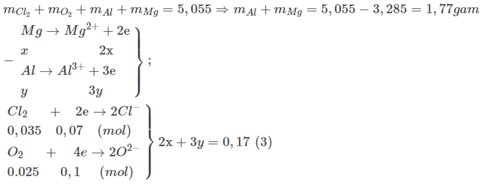
Từ (3)(4) ⇒ x = 0,04; y = 0,03
⇒ m Mg = 0,04.24 = 0,96g; m Al = 0,03.27 = 0,81g
Phản ứng không oxi hoá - khử

Chọn đáp án B
n X = 7 , 84 22 , 4 = 0,35 (mol)
Bảo toàn khối lượng: m C l 2 + m O 2 = 30,1 – 11,1 = 19 (gam)
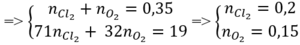

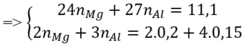
=> n M g = 0 , 35 n A l = 0 , 1 => %mAl = 0 , 1 . 27 11 , 1 .100% = 24,32%

Gọi \(n_{Mg} = a(mol) ; n_{Al} = b(mol)\\ \Rightarrow 24a + 27b = 5,7(1)\)
\(Mg^0 \to Mg^{+2} + 2e\\ Al^0 \to Al^{+3} + 3e\\ O_2 + 4e \to 2O^{-2}\\ Cl_2 + 2e \to 2Cl^-\)
Bảo toàn electron : \(2n_{Mg} + 3n_{Al} = 2a + 3b = 4n_{O_2} + 2n_{Cl_2} = 1,2(mol)\)(2)
Từ (1)(2) suy ra : a = -0,85< 0 ⇒ Sai đề
X{Mg, Al} + {Cl2, O2} → Z
Áp dụng định luật BTKL: mCl2 + mO2 = mZ – mX = 19,7 – 7,8 = 11,9 gam
Theo đề bài ta có hệ phương trình:
⎧⎪⎨⎪⎩nCl2+nO2=5,622,4=0,2571nCl2+32nO2=11,9→{nCl2=0,1nO2=0,15{nCl2+nO2=5,622,4=0,2571nCl2+32nO2=11,9→{nCl2=0,1nO2=0,15
Đặt số mol của Mg và Al lần lượt là x và y (mol)
- Khối lượng hỗn hợp: 24x + 27y = 7,8 (1)
- Bảo toàn e: 2nMg + 3nAl = 2nCl2 + 4nO2 => 2x + 3y = 0,1.2 + 0,15.4 hay 2x + 3y = 0,8 (2)
Giải (1) và (2) thu được x = 0,1 và y = 0,2
=> %mAl = 0,2.27/7,8 = 69,23%


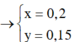

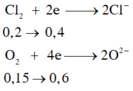

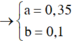
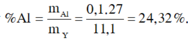


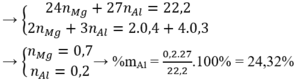

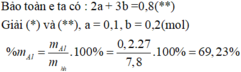
nA = 11,2/22,4 = 0,5 mol
Đặt nCl2 = x và nO2 = y (mol)
nA = x + y = 0,5 (1)
BTKL: mA = m(muối + oxit) – mKL => 71x + 32y = 42,34 – 16,98 (2)
Giải (1) và (2) thu được x = 0,24 và y = 0,26
Đặt nMg = a mol và nAl = b mol
mB = 24a + 0,26b = 16,98 (3)
BTe: 2nMg + 3nAl = 2nCl2 + 4nO2 => 2a + 3b = 2.0,24 + 4.0,26 (4)
Giải (3) và (4) thu được a = 0,55 và b = 0,14
=> %nMg = 0,55/(0,55 + 0,14).100% = 79,71%