Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a) n_{Mg} = a(mol) ; n_{Fe} = b(mol)\\ \Rightarrow 24a + 56b = 9,6(1)\\ 2Mg + O_2 \xrightarrow{t^o} 2MgO\\ 3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4\\ n_{O_2} = 0,5a + \dfrac{2}{3}b = \dfrac{2,8}{22,4} = 0,125(2)\\ (1)(2)\Rightarrow a = 0,05 ; b = 0,15\\ m_{Mg} = 0,05.24 = 1,2(gam) ; m_{Fe} = 0,15.56 = 8,4(gam)\\ b) m_{oxit} = m_A + m_{O_2} = 9,6 + 0,125.32 = 13,6(gam)\)

a, Cu không tác dụng với dd HCl.
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b, Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT: \(n_{Zn}=n_{H_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{Zn}=0,2.65=13\left(g\right)\)
\(\Rightarrow m_{Cu}=19,4-13=6,4\left(g\right)\)
c, Ta có: \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{13}{19,4}.100\%\approx67,01\%\\\%m_{Cu}\approx32,99\%\end{matrix}\right.\)
Bạn tham khảo nhé!

a) Gọi số mol Al, Fe là a, b (mol)
=> 27a + 56b = 13,9 (1)
\(n_{H_2}=\dfrac{7,84}{22,4}=0,35\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a--->3a--------------->1,5a
Fe + 2HCl --> FeCl2 + H2
b-->2b---------------->b
=> 1,5a + b = 0,35 (2)
(1)(2) => a = 0,1; b = 0,2
nHCl = 3a + 2b = 0,7 (mol)
=> mHCl = 0,7.36,5 = 25,55(g)
b)
mAl = 0,1.27 = 2,7 (g)
mFe = 0,2.56 = 11,2 (g)

\(n_{H_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Ag}=y\left(mol\right)\end{matrix}\right.\Rightarrow27x+108y=4,2\left(1\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,1 0,05 0,15
\(\Rightarrow m_{Al}=0,1\cdot27=2,7g\)
\(\Rightarrow m_{Ag}=4,2-2,7=1,5g\)
a)\(\%m_{Al}=\dfrac{2,7}{4,2}\cdot100\%=64,28\%\)
\(\%m_{Ag}=100\%-64,28\%=35,72\%\)
b)\(m_{muối}=0,05\cdot342=17,1g\)

a) Gọi số mol Al, Mg là a, b
=> 27a + 24b = 6,3
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a------------------------->1,5a
Mg + 2HCl --> MgCl2 + H2
b--------------------------->b
=> \(1,5a+b=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
=> a = 0,1; b = 0,15
=> \(\left\{{}\begin{matrix}m_{Al}=0,1.27=2,7\left(g\right)\\m_{Mg}=0,15.24=3,6\left(g\right)\end{matrix}\right.\)
b)
PTHH: MxOy + yH2 --to--> xM + yH2O
\(\dfrac{0,3}{y}\)<--0,3
=> \(M_{M_xO_y}=x.M_M+16y=\dfrac{17,4}{\dfrac{0,3}{y}}\)
=> \(M_M=21.\dfrac{2y}{x}\left(g/mol\right)\)
Xét \(\dfrac{2y}{x}=1\) => Loại
Xét \(\dfrac{2y}{x}=2\) => Loại
Xét \(\dfrac{2y}{x}=3\) => Loại
Xét \(\dfrac{2y}{x}=\dfrac{8}{3}\) => MM = 56 (g/mol) => M là Fe
a, ptpứ:
\(Mg+2HCl\rightarrow MgCl_2+H_2\left(1\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\left(2\right)\)
gọi số mol Mg là x mol , số mol Al là y mol ( x; y >0)
ta có pt : \(24x+27y=6,3\left(3\right)\)
theo bài : \(nH_2=0,3mol\)
theo ptpư(1) \(nH_2=nMg=xmol\)
theo ptpư(2) \(nH_2=\dfrac{3}{2}nAl=\dfrac{3}{2}ymol\)
tiếp tục có pt : \(x+\dfrac{3}{2}y=0,3\left(4\right)\)
từ (3) và (4) ta có hệ pt:
\(24x+27y=6,3\\ x+\dfrac{3}{2}y=0,3\)
<=> \(x=0,15\) ; \(y=0,1\)
\(mMg=24x=24.0,15=3,6gam\)
\(mAl=27y=27.0,1=2,7gam\)

PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Giả sử: \(\left\{{}\begin{matrix}n_{Fe_2O_3}=x\left(mol\right)\\n_{CuO}=y\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow160x+80y=40\left(1\right)\)
Ta có: \(n_{H_2}=\dfrac{14,56}{22,4}=0,65\left(mol\right)\)
Theo PT: \(n_{H_2}=3n_{Fe_2O_3}+n_{CuO}=3x+y\left(mol\right)\)
⇒ 3x + y = 0,65 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,15\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe_2O_3}=\dfrac{0,15.160}{40}.100\%=60\%\\\%m_{CuO}=40\%\end{matrix}\right.\)
Bạn tham khảo nhé!

Bài 1:
a, \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Cu}=\dfrac{6,4}{64}=0,1\left(mol\right)\)
Theo PT: \(n_{CuO}=n_{Cu}=0,1\left(mol\right)\Rightarrow m_{CuO}=0,1.80=8\left(g\right)\)
\(\Rightarrow m_{Fe_2O_3}=32-m_{CuO}=24\left(g\right)\)
Bài 2:
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\), \(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PT: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Xét tỉ lệ: \(\dfrac{0,1}{2}< \dfrac{0,3}{1}\), ta được O2 dư.
Theo PT: \(n_{H_2O}=n_{H_2}=0,1\left(mol\right)\Rightarrow m_{H_2O}=0,1.18=1,8\left(g\right)\)
bài 1
a)PTHH:CuO+H2➞Cu+H2O
PTHH:Fe2O3+3H2➞2Fe+3H2O
b)nCuO=\(\dfrac{32}{80}\)=0,4(m)
nCu=\(\dfrac{6,4}{64}\)=0,1(m)
PTHH : CuO + H2 ➞ Cu + H2O
tỉ lệ :1 1 1 1
số mol
ban đầu:0,4 0,1
ta có tỉ lệ:\(\dfrac{0,4}{1}\)>\(\dfrac{0,1}{1}\)=>CuO dư
PTHH : CuO + H2 ➞ Cu + H2
số mol:0,1 0,1 0,1 0,1
m\(_{CuO}\)=0,1.80=8(g)
bài 2
n\(_{H_2}\)=\(\dfrac{2,24}{22,4}\)=0,1(m)
n\(_{O_2}\)=\(\dfrac{6,72}{22,4}\)=0,3(m)
PTHH : 2H2 + O2 ➞ 2H2O
tỉ lệ : 2 1 2
số mol
ban đầu:0,1 0,3
ta có tỉ lệ:\(\dfrac{0,1}{2}\)<\(\dfrac{0,3}{1}\)=>O2 dư
PTHH : 2H2 + O2 ➞ 2H2O
tỉ lệ :2 1 2
số mol:0,1 0,05 0,1
m\(_{H_2O}\)=0,1.18=1,8(g)

\(a,n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: Ba + 2H2O ---> Ba(OH)2 + H2
0,3<-------------0,3<---------0,3
=> mBa = 0,3.137 = 41,1 (g)
=> mK2O = 59,9 - 41,1 = 18,8 (g)
\(\rightarrow\left\{{}\begin{matrix}\%m_{Ba}=\dfrac{41,1}{59,9}.100\%=68,61\%\\\%m_{K_2O}=100\%-68,61\%=31,39\%\end{matrix}\right.\)
\(b,n_{K_2O}=\dfrac{18,8}{94}=0,2\left(mol\right)\)
PTHH: K2O + H2O ---> 2KOH
0,2----------------->0,4
Các chất tan trong dd sau phản ứng: KOH, Ba(OH)2
\(\rightarrow\left\{{}\begin{matrix}m_{KOH}=0,4.56=22,4\left(g\right)\\m_{Ba\left(OH\right)_2}=0,3.171=51,3\left(g\right)\end{matrix}\right.\)
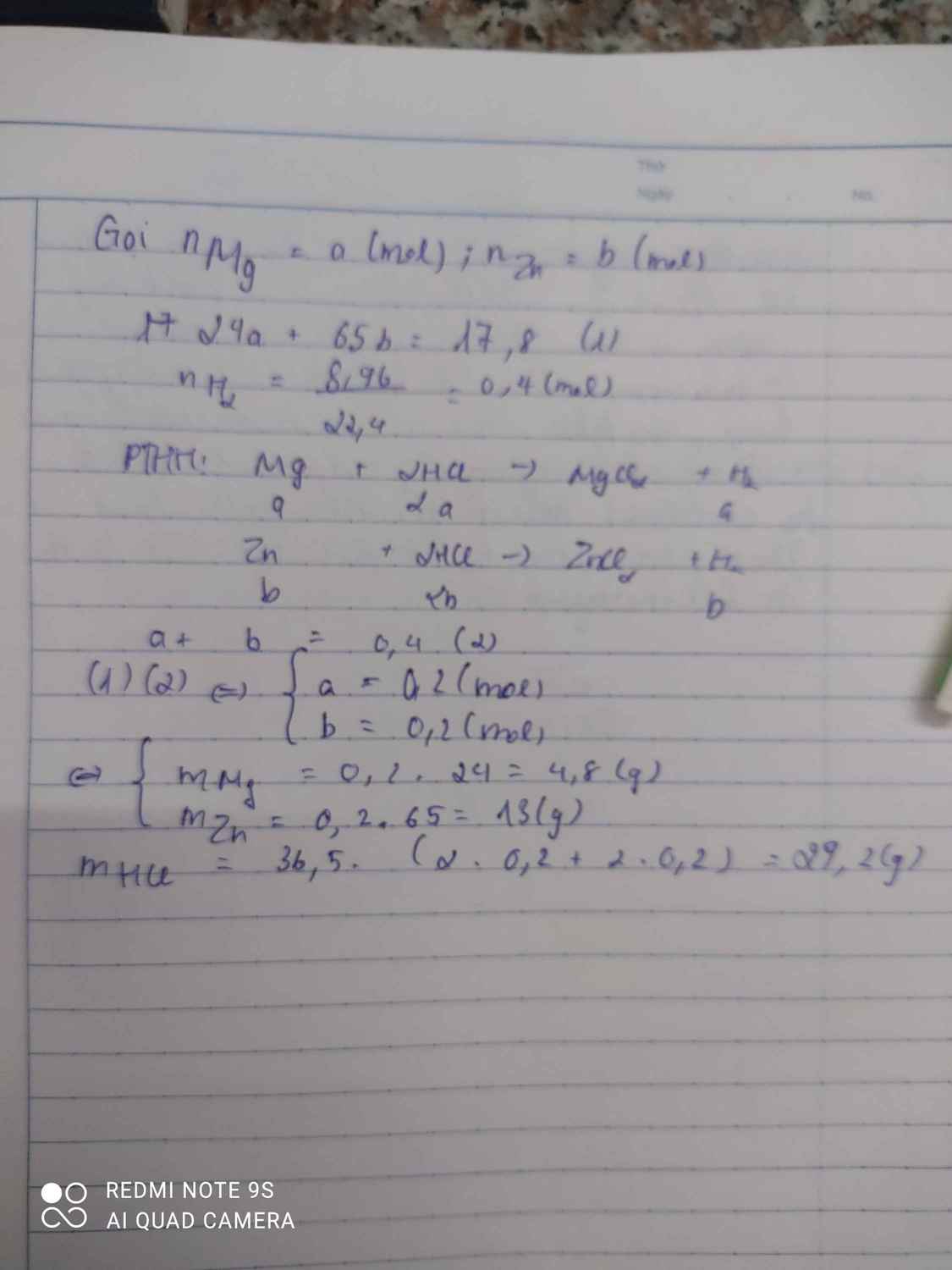
Fe3O4+4H2-to>3Fe+4H2O
x---------\(\dfrac{3}{4}x\)
CuO+H2-to>Cu+H2O
y--------y mol
Ta có :
\(\left\{{}\begin{matrix}x+y=0,5\\\dfrac{3}{4}x.56+64y=23,2\end{matrix}\right.\)
=>x=0,4 mol, y=0,1 mol
=>% m Fe3O4=\(\dfrac{0,4.232}{0,4.232+0,1.80}.100\)=92,1%
=>%m CuO=100-92,1=7,9%
\(n_{H_2}=\dfrac{11,2}{22,4}=0,5mol\)
\(Fe_3O_4+4H_2\rightarrow3Fe+4H_2O\)
x 4x 3x
\(CuO+H_2\rightarrow Cu+H_2O\)
y y y
\(\Rightarrow\left\{{}\begin{matrix}4x+y=0,5\\3\cdot56x+64y=23,2\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
\(\%m_{Fe_2O_3}=\dfrac{0,1\cdot232}{0,1\cdot232+0,1\cdot80}\cdot100\%=74,36\%\)
\(\%m_{CuO}=100\%-74,36\%=25,64\%\)