Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
pH =1 => [H+] = 0,1 => n H + = 01.01 = 0,01 mol.
n O H - = 0,1a
pH =12 => [H+] = 10-12 => [OH-] =10-2 => n O H - dư = 0,01.(0,1+0,1) = 0,002 mol
=> 0,1a - 0,01 = 0,002 => a = 0,12.

a) C% = 25.100/125 = 20%.
b) Nếu thêm 100ml nước thì V = 200 ml. ---> CM = nNa2SO4/0,2 = 28,4/142/0,2 = 1 M.

Để có được 300ml dung dịch A thi phải cần mỗi dung dịch axit là 100ml
=> tổng n H+= ( 0,1.2 + 0,2 + 0,3 ). 0,1 = 0,07 mol
Ở dung dịch B có tổng n OH− = 0,49.V mol
rõ ràng dung dịch thu được pH = 2 => dư H^+ = 0,01. ( 0,3 + v ) mol (1)
phản ứng : H+ +OH− → H2O
theo phản ứng thì nH+ dư = 0,07 - 0,49.V (2) từ 1 và 2 => 0,07 - 0,49.V = 0,01. ( 0,3 + v )
=> V = 0,134 lit
=> Đáp án D

tăng giảm khối lượng...có mol FeSO4=2,25/(65-56)=0.25(mol)
=> a=2,5M

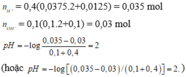

pH = 2 nên nồng độ ion H+: [H+] = 10-2 và số mol HCl = 10-3 (mol) = nH+ = nCl-
nNaOH = nNa+ = nOH- = 10-3 mol.
Khi trộn 2 dd với nhau: H+ + OH- = H2O
Vì phản ứng vừa đủ nên dung dịch thu được có môi trường trung tính, do đó: pH = 7.
Tổng thể tích thu được sau phản ứng là 200ml = 0,2 lít. Do đó: [Na+] = 10-3/0,2 = 5.10-3 (M) = [Cl-].
đáp án A