Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Ca2+ + CO32- → CaCO3 → CaO
nCa2+ = nCaO = 0,28/56 = 0,005 => [Ca2+] = 0,005/0,01 = 0,5M

Đáp án A
Ca2+ + CO32- → CaCO3↓
CaCO3 → t o CaO + CO2 ↑ (nCaO = 0,28: 56 = 0,005 mol)
=> nCa2+ = nCaCO3 = nCaO = 0,005 mol
=> CM (Ca2+) = 0,005: 0,01 = 0,5M

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 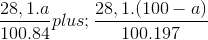 = 0,2
= 0,2
=> a = 29,89.

Mg + HCl - MgCl2 + H2
Al + HCl - AlCl3 + H2
còn Cu đứng sau H nên không phản ứng với HCl.
nCuO = \(\dfrac{16}{80}=0,2\) mol
Pt: 2Cu + O2 --to--> 2CuO
0,2 mol<--------------0,2 mol
.....Mg + 2HCl --> MgCl2 + H2
0,2 mol<-----------0,2 mol
.....2Al + 6HCl --> 2AlCl3 + 3H2
....MgCl2 + 2NaOH --> Mg(OH)2 + 2NaCl
...0,2 mol<---------------0,2 mol
....AlCl3 + 3NaOH --> Al(OH)3 + 3NaCl
....Al(OH)3 + NaOH --> NaAlO2 + 2H2O
..........................................(tan)
...Mg(OH)2 --to--> MgO + H2O
0,2 mol<------------ 0,2 mol
nMgO = \(\dfrac{8}{40}=0,2\) mol
mCu = 0,2 . 64 = 12,8 (g)
mMg = 0,2 . 24 = 4,8 (g)
mAl = mhh - mCu - mMg = 20 - 12,8 - 4,8 = 2,4 (g)
% mCu = \(\dfrac{12,8}{20}.100\%=64\%\)
% mMg = \(\dfrac{4,8}{20}.100\%=24\%\)
% mAl = \(\dfrac{2,4}{20}.100\%=12\%\)

Số mol H3PO4: 0,050 x 0,50 = 0,025 (mol).
H3PO4 + 3NaOH → Na3PO4 + 3H2O
1 mol 3 mol
0,025 mol 3 x 0,025 mol
Thể tích dung dịch NaOH: 0,075 lít hay 75 ml
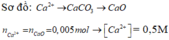
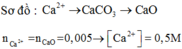
Đáp án C
Ta có quá trình biến đổi nhau sau:
CaCO3 → CaO.
⇒ Rắn đó là CaO
⇒ nCaO = 0,005 mol = nCa2+
Û CM Ca2+ =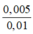 = 0,5M
= 0,5M