Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, Zn + 2HCl--> ZnCl2 + H2
b , Ta có nH2=4,48/22,4=0,2 mol
Ta có nZn PỨ = nH2= 0,2 mol
=> mZn PỨ= 0,2.65=13 g
c, Ta có nMgCl2=mH2=0,2 mol
=> CM dd MgCl2=0,2/0,07=2,857 M

a) Zn + 2HCl \(\rightarrow\) ZnCl2 + H2\(\uparrow\)
b) \(n_{H_2}=\dfrac{V}{22,4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo phương trình: \(n_{Zn}=1\) ; \(n_{H_2}=1\) ; \(n_{HCl}=2\)
Mà \(n_{H_2}=0,2\left(mol\right)\Rightarrow n_{Zn}=0,2\left(mol\right)\) ; \(n_{HCl}=0,4\left(mol\right)\)
Ta có: \(m_{Zn}=n_{Zn}.M_{Zn}=0,2.65=13\left(g\right)\)
c) Đổi: 70ml = 0,07l
\(C_M=\dfrac{n}{V}=\dfrac{0,4}{0,07}\approx5,7\left(M\right)\)

Chỉ có Zn phản ứng thôi. Cu không phản ứng, không tan.---->Chất rắn không tan là Cu
Zn+ H2SO4 ---> ZnSO4+ H2↑
0.1 0.1
nH2= 2.24: 22.4=0.1 mol
mZn= 0.1x65=6.5 g
mCu=10.5-6,5=4 g
%Zn=6.5:10.5x100%=61.9%
%Cu=4:10.5x100%=38.1%

a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b, \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(n_{Zn}=n_{H_2}=0,3\left(mol\right)\)
\(\Rightarrow m_{Zn}=0,3.65=19,5\left(g\right)\)
c, \(n_{HCl}=2n_{H_2}=0,6\left(mol\right)\)
\(\Rightarrow C_{M_{HCl}}=\dfrac{0,6}{0,1}=6\left(M\right)\)

Gọi x,y,z lần lượt là số mol của Al,Mg,Zn
PT:
2Al + 6HCl--->2AlCl3 + 3H2
x-------3x----------------------1,5x mol
Mg + 2HCl--->MgCl2 + H2
y-----2y----------------------y mol
Zn + 2HCl--->ZnCl2 + H2
z----2z--------------------z mol
b.
Số mol H2: nH2=16,352/22,4=0,73 mol
1,5x+y+z=0,73
27x = 24y =>x=8y/9
=>7y/3 +z =0,73 (*)
27x + 24y + 65z=19,6
27x = 24y
=> 48y + 65z =19,6 (**)
Từ (*),(**)
=>y=0,27 => mMg =6,48 g
z=0,1=>mZn = 6,5 g
x=0,24=>mAl =6,48g
c.
nHCl =2nH2
=>nHCl =2.0,73=1,46 mol
=>V dd=1,46/2=0,73(l)

\(n_{H_2}=\dfrac{2,479}{22,4}=\dfrac{2479}{22400}mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Theo pt ta có: \(n_{Zn}=n_{H_2}=\dfrac{2479}{22400}mol\)\(\approx0,11mol\)
\(\Rightarrow m_{Zn}\approx7,2g\)
\(n_{HCl}=2n_{H_2}=0,22mol\) \(\Rightarrow C_{M_{HCl}}=\dfrac{0,22}{0,1}=2,2M\)

Bài 3:
Khi cho tác dụng với HCl thì chỉ có Zn phản ứng
Zn + 2HCl ----> ZnCl2 + H2 (1)
0.2mol <------------------------- 0.2mol
Vậy khối lượng Zn = 13g
Nung hh trên trong không khí sẽ có các phản ứng:
Zn + O2 ----> ZnO (2)
0.2mol -----------------> 0.2mol = 16.2g
Cu + 1/2O2 ----> CuO
Ta nhận thấy Ag không phản ứng với Ôxi vậy khối lượng chất rắn tăng lên là do sự hình thành 2 ôxit ZnO và CuO. Số mol của O trong hổn hợp 2 ôxit = (51.9 - 45.5) / 16 = 0.4 mol
Theo PT (2) ta thấy số mol của O trong ZnO =số mol của ZnO = 0.2 mol, vậy số mol của O trong CuO = 0.4 - 0.2 = 0.2 mol. Số mol của Cu = 0.2 mol -> khối lượng Cu ban đầu = 0.2 * 64 = 12.8g
Khối lượng Ag trong hh ban đầu = 45.5 - 12.8 - 13 = 19.7g.
Vì Cu và Ag là hai kim loại đứng sau H2 trong dãy hoạt động của kim loại nên không thể tác dụng được với dd HCl
Theo bài ra ta có: \(nH_2=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
a) PTHH:
\(Z_n+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
\(0,2mol....................0,2mol\)
\(2Cu+O_2-^{t0}\rightarrow2CuO\)
\(2Zn+O_2-^{t0}\rightarrow2ZnO\)
\(0,2mol.......................0,2mol\)
\(Ag+O_2\ne ko-pư\)
Chất rắn thu được sau khi nung là CuO, ZnO và Ag.
Gọi x,y lần lượt là số mol của Cu và Ag
Ta có:
mZnO + mCuO + mAg = 51,9
mZn + mCu + mAg = 45,5
Ta có:
mCu + mAg = 45,5 - 0,2.65
⇔ 64x + 108y = 32,5 (1)
mCuO + mAg = 51,9 - 0,2.81
⇔ 80x + 108y = 35,7 (2)
Từ (1) và ( 2) ta được: \(\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,182\left(mol\right)\end{matrix}\right.\)
b) Thành phần % theo khối lượng có trong hỗn hợp ban đầu là:
\(\left\{{}\begin{matrix}\%mZn=\dfrac{0,2.65}{45,5}.100\%\approx28,57\%\\\%mCu=\dfrac{0,2.64}{45,5}.100\%\approx28,133\%\\\%mAg=100\%-28,75\%-28,13\%=43,3\%\end{matrix}\right.\)
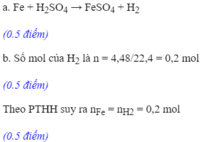

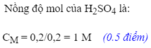
Zn + 2HCl → ZnCl2 + H2
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
b) Theo PT: \(n_{Zn}pư=n_{H_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{Zn}pư=0,2\times65=13\left(g\right)\)
c) Theo PT: \(n_{ZnCl_2}=n_{H_2}=0,2\left(mol\right)\)
\(\Rightarrow C_{M_{ZnCl_2}}=\dfrac{0,2}{0,07}=2,9\left(M\right)\)
Zn + 2HCl -> ZnCl2 + H2
Ta có:
nH2 = 4,48/22,4 = 0,2 mol
Theo pthh và bài ta có:
+ nZn = nH2 = 0,2 mol
=>mZn = 0,2 . 65 = 13 g
+ nZnCl2 = nH2 = 0,2 mol
=>CM dd ZnCl2 = 0,2 / 0,07 = 2,9 M
Vậy...