Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

n Al = a(mol) ; n Fe = b(mol)
=> 27a + 56b = 20,65(1)
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
a...........1,5a............0,5a............1.5a..(mol)
Fe + H2SO4 → FeSO4 + H2
b...........b..............b............b......(mol)
=> n H2 = 1,5a + b = 0,725(2)
Từ 1,2 suy ra a = 0,35 ; b = 0,2
Suy ra :
%m Al = 0,35.27/20,65 .100% = 45,76%
%m Fe = 100% -45,76% = 54,24%
m H2SO4 = (1,5a + b).98 = 71,05 gam
m muối = m kim loại + m H2SO4 -m H2 = 20,65 + 71,05 -0,725.2 = 90,25 gam

Gọi số mol Zn, AL là a, b (mol)
=> 65a + 27b = 3,79 (1)
\(n_{H_2}=\dfrac{1,792}{22,4}=0,08\left(mol\right)\)
PTHH: Zn + H2SO4 --> ZnSO4 + H2
a---->a------------------->a
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
b---->1,5b-------------------->1,5b
=> a + 1,5b = 0,08 (2)
(1)(2) => a = 0,05; b = 0,02
=> \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,05.65}{3,79}.100\%=85,752\%\\\%m_{Al}=\dfrac{0,02.27}{3,79}.100\%=14,248\%\end{matrix}\right.\)
\(n_{H_2SO_4}=a+1,5b=0,08\left(mol\right)\)
=> \(m_{H_2SO_4}=0,08.98=7,84\left(g\right)\)
Zn + H2SO4 -> ZnSO4 + H2
a -> a
2Al + 3H2SO4 -> Al2(SO4)3 + 3H2
b -> 1.5b
HPT: 65a+27b=3.79
a + 1.5b = 1.792/22.4= 0.08
Giải HPT ta được a=0.05 b=0.02
mZn = 0.05*65=3.25 (g)
mAl= 0.02*27=0.54 (g)

Đáp án A
Ta có sơ đồ phản ứng:
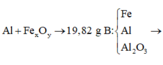
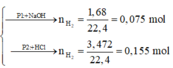
Phần 1:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
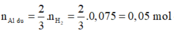
![]()
Phần 2:
2Al + 6HCl → 2AlCl3 + 3H2↑ (1)
0,05 → 0,075
Fe + 2HCl → FeCl2 + H2↑ (2)
![]()
![]()
![]()
![]()
Ta có phương trình phản ứng:
![]()
Khối lượng các chất trong 1 phần hỗn hợp B là 19,82/2 = 9,91 g
![]()
![]()
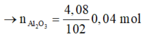
Ta có:
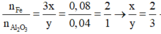
=> Oxit sắt cần tìm là Fe2O3

Xét thí nghiệm 2: chú ý tính thụ động hóa của kim loại:
H2SO4 đặc, nguội không phản ứng với Al, Cr, Fe!
⇒ trong X chỉ có Cu phran ứng. Bảo toàn electron: n Cu = n SO 2 = 0 , 075 mol.
Đặt n Cr = x mol; n Fe = y mol → m X 52x + 56y + 0,075 × 64 = 18,2 gam.
x + y = 0,25 mol. Giải hệ có: x = 0,15 mol; y = 0,1 mol.
mCr trong X = 42,86% và %mCu trong X = 26,37%
Đáp án A

Đáp án B
Theo định luật bảo toàn khối lượng, ta có:
m A = m Al , Fe 2 O 3 ban dau = 26 , 8 ( gam )
Do đó khối lượng hỗn hợp mỗi phần là 13,4 gam.
2 Al + Fe 2 O 3 → t o Al 2 O 3 + 2 Fe
Vì phần 1 tác dụng với dung dịch NaOH có xuất hiện khí và phản ứng xảy ra hoàn toàn nên hỗn hợp sau phản ứng gồm Al, Fe và A12O3.
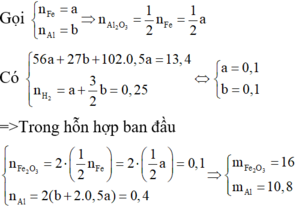

Đáp án B
· Phần 1: n Al = a 2 = n NaOH ⇒ a = 0 , 08 mol .
· Phần 2: Đặt số mol Cr2O3 trong 1 2 X phản ứng là x.
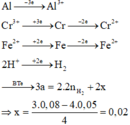
Þ Phần trăm khối lượng Cr2O3 chưa phản ứng = 0 , 03 - 0 , 02 0 , 03 . 100 % = 33 , 33 %


