Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
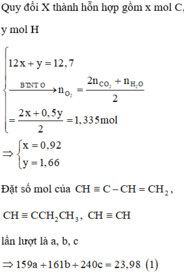
Đặt số mol của axetilen, propin, propen và hiđro trong X lần lượt là a, b, c, d.
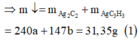
Vì Y còn làm mất màu dung dịch brom nên H 2 phản ứng hết
![]()
Áp dụng định luật bảo toàn khối lượng có:
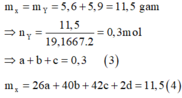
Từ (1), (2), (3), (4) suy ra
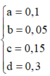
Đốt cháy Y thu được sản phẩm như đốt cháy X:
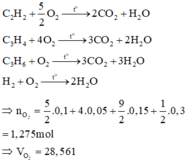

Chọn đáp án A
nCO2 = 0,24 mol. Bảo toàn khối lượng: mB = 65,76 - 0,24 × 44 = 55,2(g).
► Xét 1 phần ⇒ mB = 27,6(g). Có H2 ⇒ Al dư ⇒ B gồm Al dư, Al2O3 và Fe.
⇒ nAl = 0,06 ÷ 1,5 = 0,04 mol || nAl(OH)3 = 0,28 mol ⇒ nAl2O3 = 0,12 mol.
→ m B nFe = 0,255 mol ⇒ nSO42– = (93,36 - 0,28 × 27 - 0,255 × 56) ÷ 96 = 0,745 mol.
⇒ nH2SO4 = 0,745 mol ⇒ ∑nH+ = 0,745 × 2 + 0,23 = 1,72 mol.
● ∑nH+ = 4nNO + 10nN2O + 2nO ⇒ 4a + 10b = 1. Bảo toàn nguyên tố Nitơ:
a + 2b = 0,23 mol ||⇒ giải hệ có: a = 0,15 mol; b = 0,04 mol.
⇒ a : b = 3,75 ⇒ chọn A.

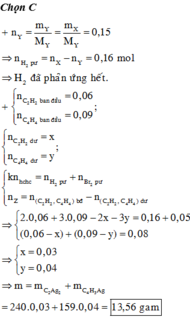

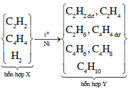
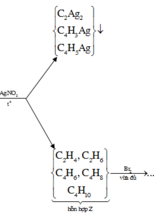
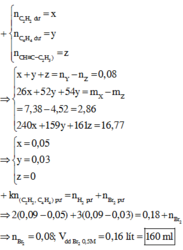
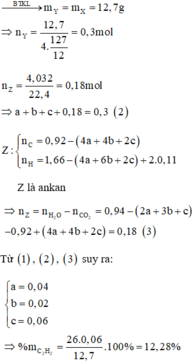
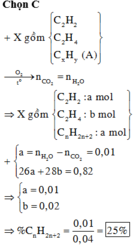

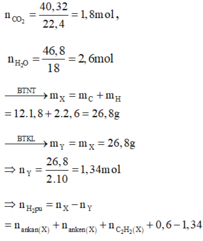


Cho x qua dung dịch Br2 chỉ có etilen và axetilen phản ứng nên propan sẽ thoát ra ngoài và có số mol là 0,1125 mol (1).
Cho x qua dung dịch AgNO3/NH3 chỉ có axetilen phản ứng tạo kết tủa theo phương trình
C2H2 + 2AgNO3 + 2NH3 → C2Ag2 ↓ + 2NH4NO3
Số mol C2Ag2 = \(\dfrac{36,36}{240}=0,1515\) mol (2)
Từ (1) và (2), số mol etilen = 0,45 - 0,1125 - 0,1515 = 0,186 mol
Trong cùng một điều kiện nhiệt độ áp suất, % thể tích = % số mol
⇒ %Vpropan = \(\dfrac{0,1125}{0,45}.100\%=25\%\)
%Vetilen = \(\dfrac{0,1515}{0,45}.100\%=33,67\%\)
%Vaxetilen = 100% - 25% - 33,67% = 41,33%