Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 24: Nhóm kim loại đều tác dụng với nước là:
A. Na , Ba, Ca , K | B. Li , Na , Cu , K | C. K , Na , Ba , Al | D. Ca , Na , Fe, K |
Câu 25: Cho thanh Al ngâm vào dung dịch axit clohidric thấy có khí bay lên. Xác định khí đó là
A. Cl2 | B. NH3 | C. H2O | D. H2 |

Câu 21: Kim loại nào không tác dụng với H2SO4 loãng
A. Al | B. Zn | C. Cu | D. Fe |
Câu 22: Cho các kim loại Fe,Zn, Al lần lượt tác dụng với dung dịch HCl. Nếu cho cùng số mol mỗi kim loại trên tác dụng với axit HCl thì kim loại nào cho nhiều hidro hơn?
A. Fe và Zn. | B. Al. | C. Zn. | D. Fe. |
Câu 23: Dãy oxit nào có tất cả các oxit đều tác dụng được với nước.
A. SO3, Na2O, CaO, P2O5 | B. SO2, Al2O3, HgO, K2O |
C. SO3 , CaO, CuO, Fe2O3 | D. ZnO, CO2, SiO2, PbO |
21 C
22
Zn + 2HCl ----> ZnCl2 + H2
x.........................................x
Fe + 2HCl ---->FeCl2 + H2
x........................................x
2Al + 6HCl ----> 2AlCl3 + 3H2
x.........................................1,5x => 22 b
23 A

Câu 34: Oxi có thể tác dụng với dãy chất nào sau đây?
| K, Cl2, CH4. | Ca, C, CaCO3. |
| Au, P, C4H10 . | D. Na, S, C2H4. |
Câu 35: Cho các oxit sau: CO2, FeO, SO2, CaO. Số lượng oxit axit trong dãy trên là:
A. 1 B. 2 C. 3 D. 4

Câu 18: Cho 32,5g Zn vào bình đựng nước dung dịch chứa 0,05 mol HCl. Thể tích khí H2 (đktc) thu
được là:
A. 11,2lít | B. 22,4 lít | C. 0,56lít | D. 33,6 lít |
Câu 19: Cho 48g CuO tác dụng với khí H2 khi đun nóng.Thể tích khí H2 (đktc)cần cho phản ứng trên là:
A. 13,44 lít | B. 11,2 lít | C. 13,88 lít | D. 14,22 lít |

\(1752ml=1,752l\)
\(n_{Na_2O}=\frac{m}{M}=\frac{24,8}{62}=0,4mol\)
PTHH: \(Na_2O+H_2O\rightarrow2NaOH\)
0,4 0,8 mol
\(V_{sau}=V_{H_2O}=1,752l\)
\(\rightarrow n_{NaOH}=n_{Na_2O}=\frac{2.0,4}{1}=0,8mol\)
\(\rightarrow C_{M_{NaOH}}=\frac{n}{V_{sau}}=\frac{0,8}{1,752}\approx0,46M\)
Bạn xem lại đề nhé, nếu tính nồng độ % sẽ cho mdd
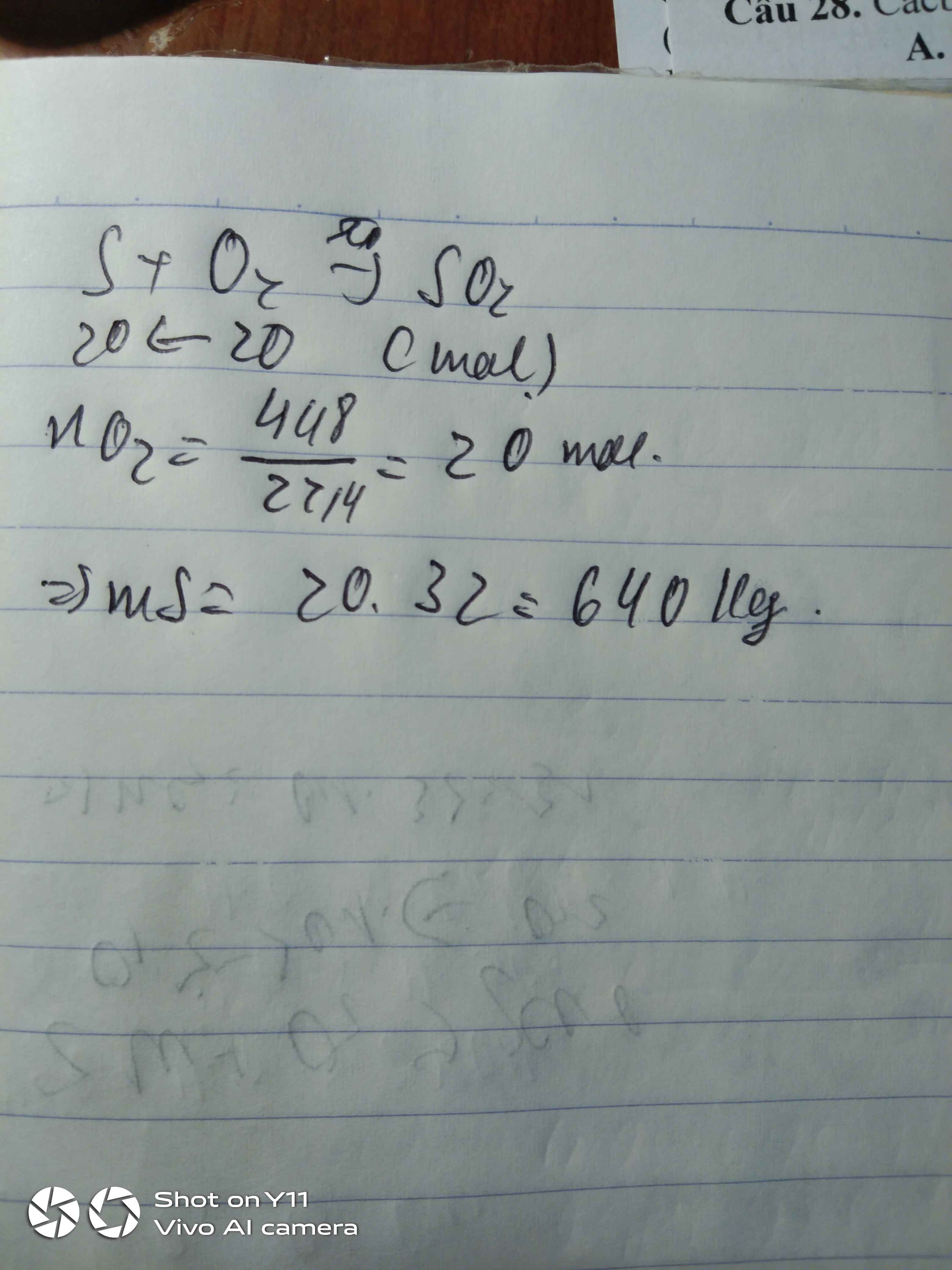
c không khí h2o
học tốt nhé
A. CaCO3. KClO3
D. KClO3,KMnO4.