Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nH2=0.56:22,4=0,025 mol
Fe+H2SO4----->FeSO4+H2
2AL+3H2SO4----->AL2(SO4)3 +3H2
Gọi x,y làn lượt là số mol Fe và AL
ta có hệ pt
\(\begin{cases}56x+27y=0,83\\x+1,5y=0,025\end{cases}\)
\(\begin{cases}x=0,01mol\\y=0,01mol\end{cases}\)
mFe=0,01.56=0,56 g
mAl=0,83-0,56=0,27 g
%mFe=(0,56:0,83).100=67,47%
%mAl=100-67,47=32,53%

Số mol khí H2 = 0,56: 22,4 = 0,025 mol.
Gọi X, у là số mol của Al, Fe.
Phương trình hóa học:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
p.ư : x l,5x (mol)
Fe + H2SO4 -> FeSO4 + H2
y —> y (mol)
Theo khối lượng hỗn hợp và mol H2 ta có hệ phương trình:
Giải ra ta có: x = y = 0,01 = nAl = nFe
%Al = .100% = 32,53% ; %Fe = 100 - 32,53 = 67,47%
Gọi x, у là số mol của Al, Fe =>27x + 56y = 0,83 gam (*)
PTHH 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 (1)
(mol) x l,5x
Fe + H2SO4 → FeSO4 + H2 (2)
(mol) y y
Từ phương trình hóa học (1) và (2) ta có
nH2 = 0,56/22,4 = 0,025 = 1,5x + y (**)
Từ (*) và (**) =>x = y = 0,01 = nAl = nFe
Phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu là:
%Al = (0,01.27 / 0,83) . 100% = 32,53% ;
%Fe = 100 - 32,53 = 67,47%

Ta có nH2 = 3,36/22,4 = 0,15 mol
Fe +2 HCl -> FeCl2 + H2
0,15. 0,3 <-. 0,15. ( Mol)
=> mFe = 0,15 × 56 = 8,4g
=> %Fe = 8,4/15×100% = 56%
=> %Cu = 100% - 56% = 44%
=>VHCl =1\0,3=10\3 l

a, Ta có: 65nZn + 27nAl = 11,9 (1)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Theo PT: \(n_{H_2}=n_{Zn}+\dfrac{3}{2}n_{Al}=\dfrac{9,916}{24,79}=0,4\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Zn}=0,1\left(mol\right)\\n_{Al}=0,2\left(mol\right)\end{matrix}\right.\)
⇒ mZn = 0,1.65 = 6,5 (g)
mAl = 0,2.27 = 5,4 (g)
b, Theo PT: nZnCl2 = nZn = 0,1 (mol)
nAlCl3 = nAl = 0,2 (mol)
⇒ m muối = 0,1.136 + 0,2.133,5 = 40,3 (g)
c, Theo PT: nHCl = 2nH2 = 0,8 (mol)
\(\Rightarrow m_{ddHCl}=\dfrac{0,8.36,5}{10\%}=292\left(g\right)\)

a) Fe + 2HCl --> FeCl2 + H2
b) \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
_____0,15<--------------------0,15
=> mFe = 0,15.56 = 8,4 (g)
=> mCu = 15-8,4 = 6,6 (g)
c) Số nguyên tử Fe = 0,15.6.1023 = 0,9.1023

a,\(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH: Zn + 2HCl → ZnCl2 + H2
Mol: x x
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: y y
Ta có: \(\left\{{}\begin{matrix}65x+56y=30,7\\x+y=0,5\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,3\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\%m_{Zn}=\dfrac{0,3.65.100\%}{30,7}=63,52\%;\%m_{Fe}=100\%-63,52\%=36,48\%\)
b,
PTHH: Zn + 2HCl → ZnCl2 + H2
Mol: 0,3 0,6
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: 0,2 0,4
nHCl = 0,6+0,4 = 1 (mol)
\(V_{ddHCl}=\dfrac{1}{2}=0,5\left(l\right)=500\left(ml\right)\)

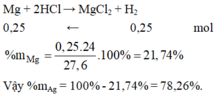
\(a,n_{H_2}=\dfrac{3,36}{22,4}=0,15(mol)\\ PTHH:Fe+2HCl\to FeCl_2+H_2\\ \Rightarrow n_{Fe}=n_{H_2}=0,15(mol)\\ \Rightarrow m_{Fe}=0,15.56=8,4(g)\\ \Rightarrow \%_{Fe}=\dfrac{8,4}{15}.100\%=56\%\\ \Rightarrow \%_{Cu}=100\%-56\%=44\%\\ b,n_{HCl}=2n_{H_2}=0,3(mol)\\ \Rightarrow C_{M_{HCl}}=\dfrac{0,3}{0,1}=3M\)