Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

HD:
M2O3 + 6HCl ---> 2MCl3 + 3H2O
Số mol HCl = 1.0,6 = 0,6 mol. Theo pt trên số mol oxit = 1/6 số mol HCl = 0,1 mol. Suy ra phân tử khối của oxit = 10,2/0,1 = 102. Suy ra: 2M + 48 = 102 hay M = 27 (Al).
a) Công thức cần tìm là Al2O3.
b) Khối lượng dd HCl = 600.1,12 = 672 gam. Khối lượng dd sau phản ứng = 672 + 10,2 = 682,2 gam.
Số mol AlCl2 = 1/3 số mol HCl = 0,2 mol. Suy ra: C%(AlCl3) = 0,2.133,5/682,2 = 3,91%.

Đầu bài cho oxit kim loại tác dụng với 300 ml dd x thôi mà, trong khi 1,2 mol HCl lại là số mol có trong 500 ml dd.
Tuy vậy thì tính theo 300 ml cũng ko ra. :vv

Để xác định oxit kim loại chưa rõ hoá trị trong bài toán này, ta cần sử dụng phương pháp tính toán dựa trên phản ứng hóa học.
Ta biết rằng muối được tạo thành từ phản ứng giữa oxit kim loại với axit clohidric (HCl). Với số mol muối thu được là n = 38g / (khối lượng mol muối), ta cần tìm khối lượng mol muối để tính toán số mol oxit kim loại ban đầu.
Theo phương trình phản ứng, ta biết rằng số mol muối bằng số mol oxit kim loại ban đầu. Vậy số mol oxit kim loại ban đầu cũng là n.
Số mol oxit kim loại ban đầu có thể tính bằng công thức: n = (số mol axit) x (tỷ lệ mol axit và muối) = (nồng độ axit) x (thể tích axit) x (tỷ lệ mol axit và muối)
Trong trường hợp này, ta có nồng độ axit HCl là 1M và thể tích axit HCl là 800ml. Tỷ lệ mol axit và muối là 1:1 theo phương trình phản ứng.
Vậy số mol oxit kim loại ban đầu là: n = 1M x 800ml x 1 = 800 mol
Tiếp theo, ta cần tìm khối lượng mol oxit kim loại ban đầu bằng cách sử dụng tỷ lệ khối lượng mol và số mol của chất.
Khối lượng mol oxit kim loại ban đầu có thể tính bằng công thức: m = n x khối lượng mol oxit
Vậy khối lượng mol oxit kim loại ban đầu là: m = 800 mol x (khối lượng mol oxit)
Cuối cùng, ta cần tìm tên của oxit kim loại chưa rõ hoá trị. Để làm điều này, cần biết khối lượng mol oxit và so sánh với các khối lượng mol của các oxit kim loại có thể có.
Tóm lại, để xác định oxit kim loại chưa rõ hoá trị, ta cần tính số mol oxit kim loại ban đầu, sau đó tính khối lượng mol oxit kim loại ban đầu. Cuối cùng, so sánh khối lượng mol oxit kim loại ban đầu với các khối lượng mol oxit kim loại có thể có để xác định tên của oxit kim loại.

\(n_{Fe_2O_3}=\dfrac{0,16}{160}=0,001\left(mol\right)\)
PTHH: \(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
0,001---->0,006---->0,002
\(\rightarrow\left\{{}\begin{matrix}V=\dfrac{0,006}{2}=0,003\left(l\right)\\a=0,002.162,5=0,325\left(g\right)\end{matrix}\right.\)

Câu 3. Hòa tan 13,7 gam Ba trong 250ml H2O (D = 1,008 g/ml) thu được dung dịch X và khí Y (đktc)
a) Tính C% của dung dịch X.
b) Lấy 212,4 gam dung dịch X tác dụng với 14,7 gam dung dịch H2SO440% thu được dung dịch Z. Tìm C% các chất tan trong Z.
Giải :
\(a)n_{Ba}=\dfrac{13,7}{137}=0,1\left(mol\right)\\ Ba+H_2O\rightarrow Ba\left(OH\right)_2+H_2\\ n_{Ba\left(OH\right)_2}=n_{H_2}=n_{Ba}=0,1\left(mol\right)\\m_{H_2}=0,1.2=0,2\left(g\right)\\ m_{H_2O}=250.1,008=252\left(g\right)\\ m_{ddsaupu}=13,7+252-0,2=265,5\left(g\right)\\ C\%_{Ba\left(OH\right)_2}=\dfrac{0,1.171}{265,5}.100=\dfrac{380}{59\%}= 6,44\%\\b)n_{Ba\left(OH\right)_2}=\dfrac{212,4.\dfrac{380}{59}\%}{171} =0,08\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{14,7.40\%}{98}=0,06\left(mol\right)\\ Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4+2H_2O\\ Lậptỉlệ:\dfrac{0,08}{1}>\dfrac{0,06}{2}\Rightarrow Ba\left(OH\right)_2dư\\ n_{BaSO_4}=n_{H_2SO_4}=0,06\left(mol\right)\\ m_{ddsaupu}=212,4+14,7-0,06.233=213,12\left(g\right)\\ n_{Ba\left(OH\right)_2pư}=n_{H_2SO_4}=0,06\left(mol\right)\\ n_{Ba\left(OH\right)_2dư}=0,08-0,06=0,02\left(mol\right)\\ \Rightarrow C\%_{Ba\left(OH\right)_2dư}=\dfrac{0,02.171}{213,12}.100=1,61\%\)
5. \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\\ n_{H_2}=n_{Fe}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ \Rightarrow\%m_{Fe}=\dfrac{0,1.56}{37,6}.100=14,89\%;\%m_{Fe_2O_3}=100-14,89=85,11\%\)

Đáp án C
Đặt công thức của oleum là H2SO4.nSO3
Khi hòa tan oleum vào nước:
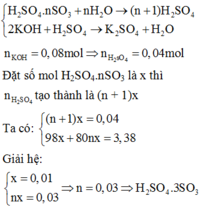

Đặt công thức của oleum là H2SO4.nSO3
Khi hòa tan oleum vào nước:

Đáp án C

a)
nNaOH = 0,04.1 = 0,04 (mol)
PTHH: NaOH + HCl --> NaCl + H2O
0,04--->0,04
=> nHCl(pư với X) = 0,2.1 - 0,04 = 0,16 (mol)
Gọi số mol CuO, Fe2O3 là a, b (mol)
=> 80a + 160b = 4,8 (1)
PTHH: CuO + 2HCl --> CuCl2 + H2O
a----->2a
Fe2O3 + 6HCl --> 2FeCl3 + 3H2O
b----->6b
=> 2a + 6b = 0,16 (2)
(1)(2) => a = 0,02; b = 0,02
=> \(\left\{{}\begin{matrix}\%m_{CuO}=\dfrac{0,02.80}{4,8}.100\%=33,33\%\\\%m_{Fe_2O_3}=\dfrac{0,02.160}{4,8}.100\%=66,67\%\end{matrix}\right.\)
b) Chất rắn thu được gồm CuO, Fe2O3
Bảo toàn Cu: nCuO = 0,02 (mol)
Bảo toàn Fe: nFe2O3 = 0,02 (mol)
=> m = 0,02.80 + 0,02.160 = 4,8 (g)
Gọi công thức sắt oxit là FexOy
\(Fe_xO_y+2yHCl\rightarrow xFeCl_{\frac{2y}{xx}}+yH_2O\)
\(m_{dd_{HCl}}=52,14.1,05=54,747\left(g\right)\)
\(m_{HCl}=\frac{54,747.10}{100}=5,4747\left(g\right)\)
\(\rightarrow n_{HCl}=0,15\left(mol\right)\)
Ta có :
\(n_{FexOy}=\frac{1}{2y}n_{HCl}\)
\(\Leftrightarrow\frac{4}{56x+16y}=\frac{0,15}{2y}\)
\(\Leftrightarrow8y=8,4x+2,4y\)
\(\Leftrightarrow\frac{x}{y}=\frac{5,6}{8,4}=\frac{2}{3}\)
\(\rightarrow x=2;y=3\)
Vậy công thức là Fe3O3