Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Nhiệt phân hoàn toàn X ⇒ Y gồm Fe, Al2O3 và Al dư.
► Xét phần 2: nAl = nH2 ÷ 1,5 = 0,01 mol; nFe = 0,045 mol
⇒ ne cho TỐI ĐA = 0,01 × 3 + 0,045 × 3 = 0,165 mol.
||⇒ phần 1 gấp 0,165 × 3 ÷ 0,165 = 3 lần phần 2.
► Xét phần 1: chứa 0,03 mol Al; 0,135 mol Fe.
||⇒ nAl2O3 = (14,49 – 0,03 × 27 – 0,135 × 56) ÷ 102 = 0,06 mol.
⇒ nO = 0,18 mol ⇒ x : y = 0,135 ÷ 0,18 = 3 : 4 ⇒ Fe3O4.
● m = 4 3 × 14,49 = 19,32(g)

Đáp án B
Quy đổi phần 1: thành 3 nguyên tố Al, Fe, O với số mol tương ứng là x, y, z.
27x + 56y + 16z = 14,49. (1)
Khi tác dụng với HNO3 dư thu khí NO: 0,165 mol.
Bảo toàn electron: 3x + 3y – 2z = 3nNO
3x + 3y – 2z = 3.0,165 = 0,495 (2)
Quy đổi phần 2: Al, Fe, O với số mol tương ứng là:kx, ky, kz
( Vì đề bài cho hai phần không bằng nhau)
Khi tác dụng với NaOH . Fe không phản ứng.
Bte: 3nAl – 2nO = 2nH2
3kx – 2kz = 0,03 (3)
Rắn còn lại là Fe: ky = 0,045 (4).
Lấy (3)/(4) → 3 x - 2 z y = 2 3 → 9x -2y – 6z – 0(4)
→ x = 0,15, y = 0,135, z = 0,18
Công thức oxit: y 2 = 0 , 135 0 , 18 = 3 4 → F e 3 O 4
(4) → k = 0 , 045 0 , 135 = 1 3
m d a u = m 1 + m 2 = m 1 + m 1 3 = 4 m 1 3 = 27 . 0 , 15 + 56 . 0 , 135 + 16 . 0 , 18 . 4 3 = 19 , 32 g

Phần 2:
nFe = 2,52/56=0,045 ; nAl = 2/3 nH2=0,01
=> nFe:nAl=9:2
Phần 1 :
Giả sử nFe=9x, nAl=2x
Ta có : 3nNO=3nFe+3nAl => 3(9x+2x)=3.0,165
=> x= 0,015 => nFe=0,135; nAl=0,03
=> nAl2O3=(14,49-0,135.56-0,03.27)/102=0,06
=>nFe:nO=3:4 => oxit sắt là Fe3O4
nFe: nAl2O3 = 9:4 => nAl2O3(phần 1)=0,02
=> X gồm 0,2 mol Al và 0,06 mol Fe3O4
=> m= 0,2.27+0,06.232=19,32g
=> Đáp án B

Phần 2 => mol Al = 0,01 ; mol Fe = 0,045 => ti lệ Al : Fe = 2/9
Đặt a, b, c là mol Al2O3 ; Al ; Fe
102a + 27b + 56c = 14,49
3b + 3c = 0,165*3
9b - 2c = 0
=> a = 0,06 ; b = 0,03 ; c = 0,135 => CT oxit sắt: Fe3O4
và phần 1 = 3*phần 2 => mol Al = 0,01 ; mol Fe = 0,045
=> ti lệ Al : Fe = 2/9 Đặt a, b, c là mol Al2O3 ; Al ; Fe
102a + 27b + 56c = 14,49 3b + 3c = 0,165*3
9b - 2c = 0
=> a = 0,06 ; b = 0,03 ; c = 0,135 => CT oxit sắt: Fe3O4
và phần 1 = 3*phần 2 => m = 19,32 2 => m = 19,32
=> Đap an B

Chọn đáp án A.
![]()
· Phần 1 + NaOH dư → 0,075 mol H2 + 5,6g Fe
n A l = 2 3 n H 2 = 0 , 05 m o l
n A l p h ả n ứ n g = n F e = 5 , 6 56 = 0 , 1 m o l
· Phần 2 + 1,7 mol HNO3 → 0,15 mol NO + m gam muối
=> HNO3 phản ứng hết.
Giả sử phần 2 có khối lượng gấp k lần phần 1.
![]()
⇒ k = 2
=> Phần 2 gồm: 0,2 mol Fe, 0,1 mol Al, 0,1 mol Al2O3.
Đặt a, b lần lượt là số mol của Fe2+, Fe3+ tạo thành.
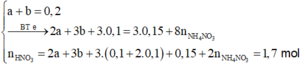
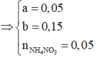
![]()
Gần nhất với giá trị 113

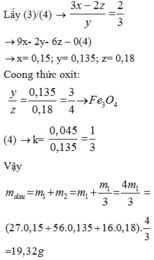
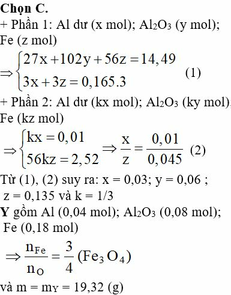

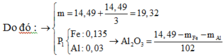
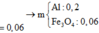
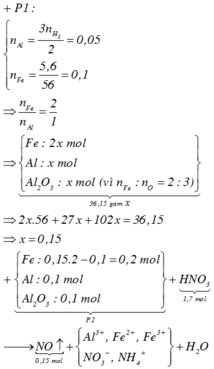
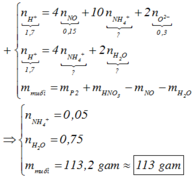
2yAl + 3FexOy = yAl2O3 + 3xFe (1)
Phần 2 + NaOH sinh ra khí, điều đó chứng tỏ Al còn dư sau p.ứ trên.
Al + NaOH + H2O = NaAlO2 + 3/2H2(khí)
Al2O3 có p.ư nhưng ko tạo ra khí. 2,52 gam chất rắn còn lại là của Fe sinh ra sau p.ư (1).
Phần 1, chỉ có Al dư (a mol) và Fe (b mol) tác dụng với HNO3 sinh ra khí NO.
Lập hệ phương trình hai phần trên, giải ra sẽ được các số mol, từ đó tính được m.
Good luck!
đáp án C