Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi x,y lần lượt là số mol của Zn và Al
Theo đề ta có mHỗnhợp=65x+27y=9,2(1)
nSO2=5,6:22,4=0,25mol
BTE:2x+3y=2.0,25=0,5(2)
Từ (1) và (2) => x=0,1;y=0,1
mAl=0,1.27=2,7g
Gọi x,y lần lượt là số mol của Zn và Al
Theo đề ta có mHỗnhợp=65x+27y=9,2(1)
nSO2=5,6:22,4=0,25mol
BTE:2x+3y=2.0,25=0,5(2)
Từ (1) và (2) => x=0,1;y=0,1
mAl=0,1.27=2,7g
Chúc bạn học tốt!!!

\(a.2Fe+6H_2SO_{4\left(đặc\right)}\rightarrow\left(t^o\right)Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\\ n_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ n_{Fe}=\dfrac{2}{3}.0,15=0,1\left(mol\right)\\ n_{Fe_2\left(SO_4\right)_3}=\dfrac{0,15}{3}=0,05\left(mol\right)\\ a,m=m_{Fe}=0,1.56=5,6\left(g\right)\\ b,m_{Fe_2\left(SO_4\right)_3}=400.0,05=20\left(g\right)\)

áp dụng công thức
v = ΔC\Δt = 0,22 - 0,1 \ 4 = 0,03 (M\s)�‾=Δ�Δ�=0,22−0,14=0,03(��)

Hòa tan hỗn hợp 1,69g Oleum có công thức H2SO4.3SO3 vào nước dư. Trung hòa dung dịch thu được Vml dung dịch KOH 1M. Giá trị của V là:
A.20
B.40
C.30
D.10
Giải thích:
\(H2SO4.3SO3+H2O=4H2SO4\)
\(n\left(o\le um\right)=0.005mol\)
\(\Rightarrow nH2SO4=0.005.4=0.02mol\)
\(H2SO4+2KOH=K2SO4+H2O\)
\(\Rightarrow nKOH=0.04\)
\(\Rightarrow\) Giá trị của V là: 40

1.
* Thí nghiệm 1: Fe + CuSO4 → FeSO4 + Cu
Quá trình oxi hóa: Fe0 → Fe+2 + 2e
Quá trình khử: Cu+2 + 2e → Cu0
* Thí nghiệm 2: Fe + H2SO4 → FeSO4 + H2
Quá trình oxi hóa: Fe0 → Fe+2 + 2e
Quá trình khử: 2H+ + 2e → H20
2.
* Thí nghiệm 1:
- Chất oxi hóa CuSO4
- Chất khử Fe
* Thí nghiệm 2:
- Chất oxi hóa H2SO4
- Chất khử Fe

a) Phương trình hóa học của phản ứng
Na2CO3 + 2HNO3 → 2NaNO3 + CO2 + H2O
b) Thí nghiệm có thể xảy ra nên điều kiện phản ứng được thỏa mãn
=> Axit mới sinh ra H2CO3 yếu hơn HNO3 nên đã phân hủy thành khí CO2 và H2O
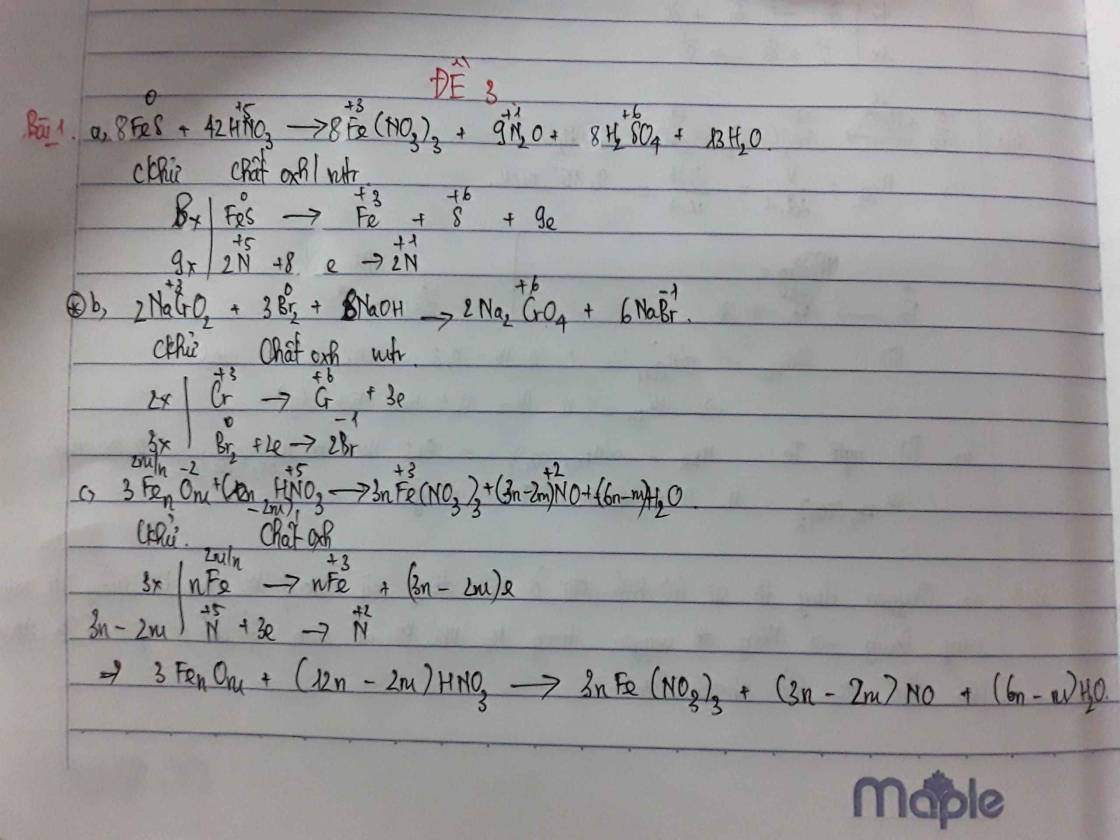
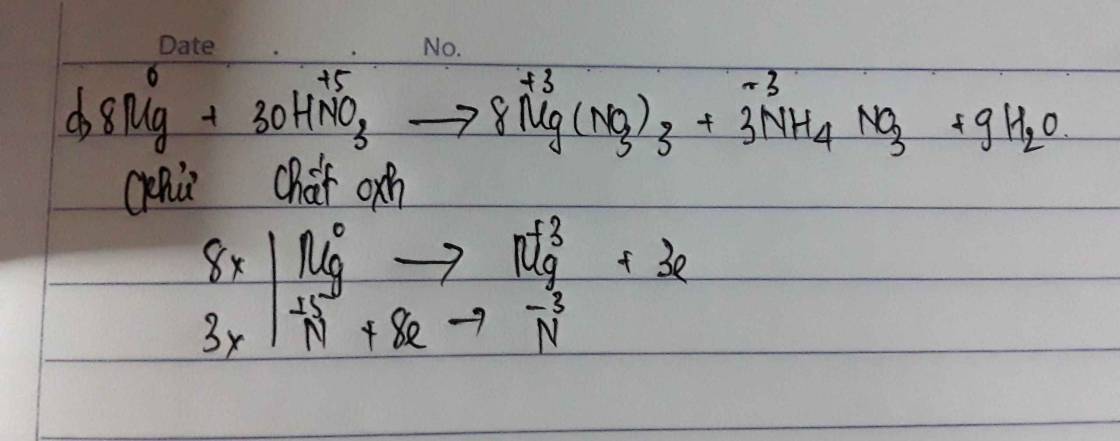
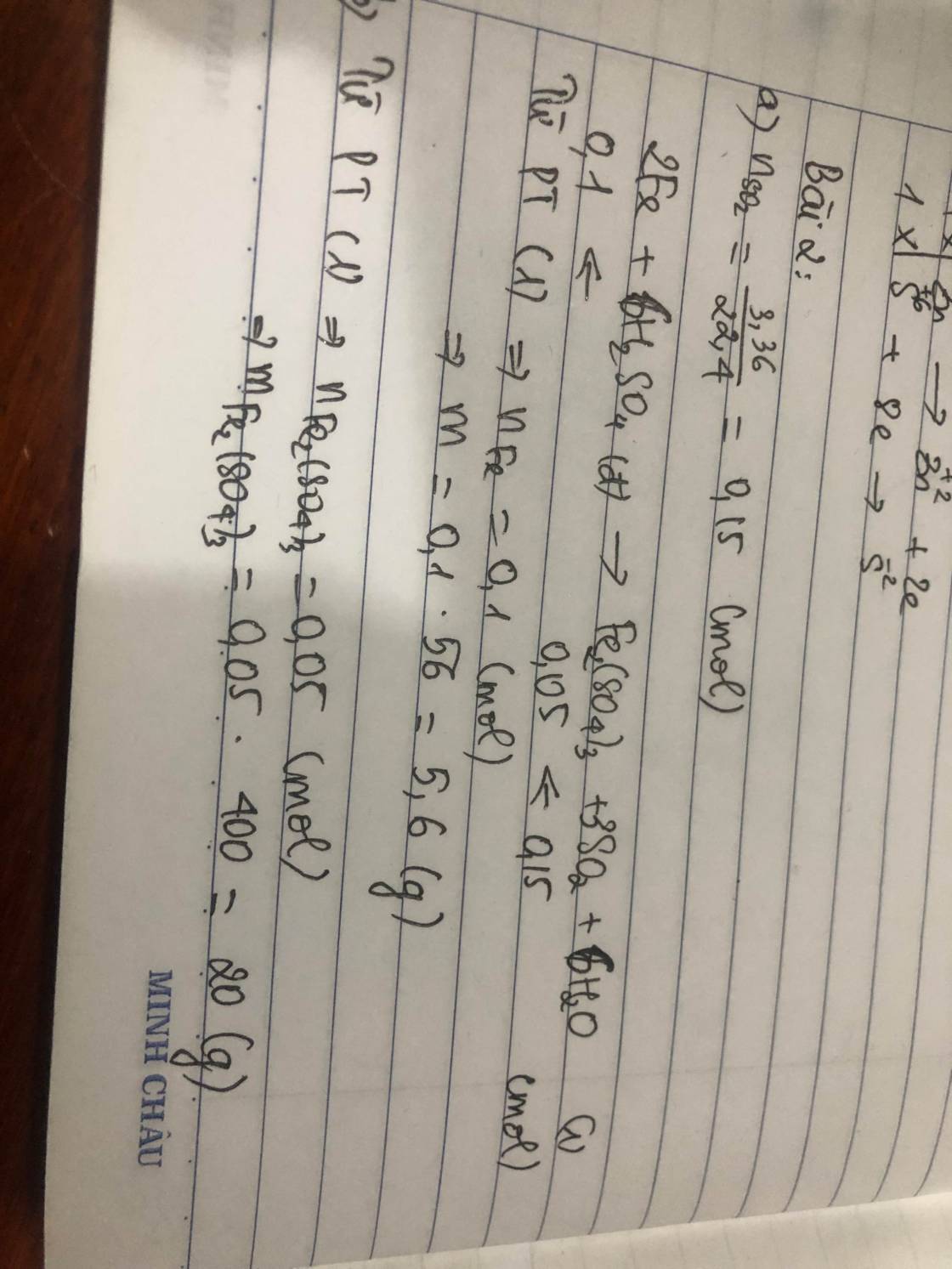
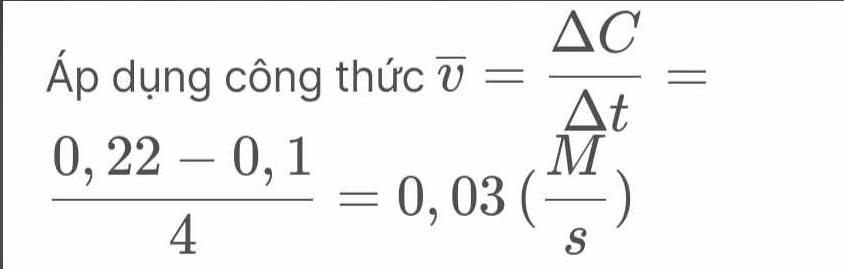


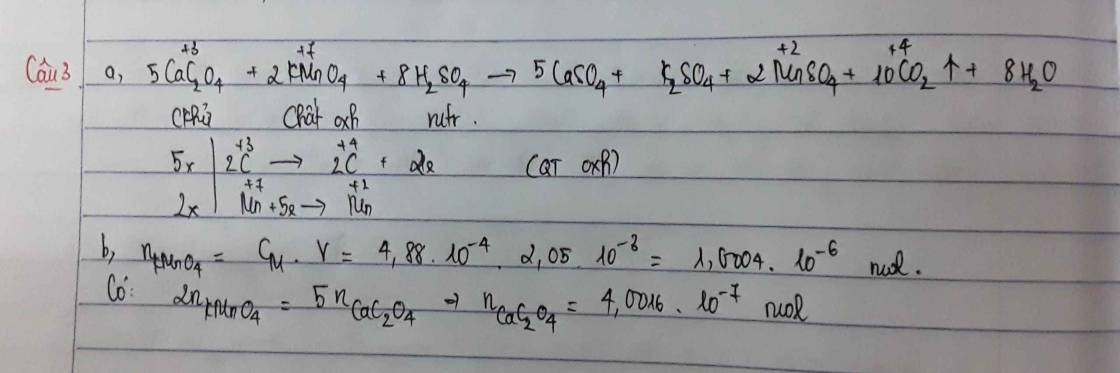
Câu 31: D
10Al + 36HNO3 --> 10Al(NO3)3 + 3N2 + 18H2O
0,1------------------------------------>0,03
=> D
Câu 32: D
2KMnO4 + 10FeSO4 + 8H2SO4 --> 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
=> D
Câu 33: A
Câu 34: B
Câu 35: B