Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 3. Lập phương trình hoá học cho các phản ứng sau :
2.) Kẽm tác dụng với H2SO4 tạo ra khí hiđro và kẽm sunfat
\(Zn+H2SO4\rightarrow ZnSO4+H2\uparrow\)
3.) Magiê tác dụng với HCl tạo ra khí hiđro và Magiêclorua
\(Mg+2HCl\rightarrow MgCl2+H2\uparrow\)
4.) Sắt (III) oxit Fe2O3 tác dụng với H2SO4 tạo ra nước và sắt (III) sunfat
\(Fe2O3+H2SO4\rightarrow H2O+Fe2\left(SO4\right)3\)
Bài 5: Cho hỗn hợp 2 muối X2SO4, YSO4 có khối lượng 22, 1g tác dụng với dung dịch 31, 2g BaCl2, thu được 34, 95g chất rắn BaSO4 và a (g) 2 muối tan. Xác định a.
---------------------------------------------------------------------------------------------------------------------------------
\(Ta-c\text{ó}-PTHH:\)
(1) \(X2SO4+BaCl2\rightarrow B\text{aS}O4\downarrow+2XCl\)
(2) \(YSO4+BaCl2\rightarrow B\text{aS}O4\downarrow+YCl2\)
Muối tan thu được sau P/Ư là muối clorua
Gọi chung hh 2 muối ban đầu là A
Ta có PTHHTQ :
\(A+BaCl2\rightarrow B\text{aS}O4+Mu\text{ối}-clorua\)
Áp dụng ĐLBTKL ta có :
mA + mBaCl2 = mBaSO4 + m\(_{mu\text{ối}-clorua}\)
=> m\(_{mu\text{ối}-clorua}=a=mA+mBaCl2-mBaSO4=22,1+31,2-34,95=18,35\left(g\right)\)
Vậy a = 18,35 (g)
Câu 6 bạn xem lại đề nhé

CaCO3 →to CaO + CO2 (1)
MgCO3 →to MgO + CO2 (2)
\(n_{CO_2}=\dfrac{15,4}{44}=0,35\left(mol\right)\)
Gọi \(x,y\) lần lượt là số mol của CaCO3 và MgCO3
Theo PT1: \(n_{CO_2}=n_{CaCO_3}=x\left(mol\right)\)
Theo PT2: \(n_{CO_2}=n_{MgCO_3}=y\left(mol\right)\)
Ta có: \(\left\{{}\begin{matrix}100x+84y=31,8\\x+y=0,35\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,15\\y=0,2\end{matrix}\right.\)
Vậy \(n_{CaCO_3}=0,15\left(mol\right);n_{MgCO_3}=0,2\left(mol\right)\)
Theo PT1: \(n_{CaO}=n_{CaCO_3}=0,15\left(mol\right)\)
\(\Rightarrow m_{CaO}=0,15\times56=8,4\left(g\right)\)
Theo PT2: \(n_{MgO}=n_{MgCO_3}=0,2\left(mol\right)\)
\(\Rightarrow m_{MgO}=0,2\times40=8\left(g\right)\)
\(\Sigma m_{oxit}=m_{CaO}+m_{MgO}=8,4+8=16,4\left(g\right)\)

- pt: Zn + 2HCl -> ZnCl2 +H2
- nHCl = ( 3,25 : 65 ) x 2 = 0,1 (mol)
V = 0,1 : 0,5 = 0,2 (l)
- gọi a là số mol cần tìm
- pt: 2Al + 3H2SO4 -> Al2(SO4)3 + 3H2
a -> 3/2a
Fe + H2SO4 -> FeSO4 + H2
a -> a
- ta có : a + 3/2a = 0,05 => a = 0,02 (mol)
- C%Fe = ( 0,02 x 56)x100 / (0,02x56 + 0,02x 27) = 67,47%
- C% Al = 100 -67,47= 32,53%

a)
\(Zn + 2HCl \to ZnCl_2 + H_2\\ Fe_2O_3 + 6HCl \to 2FeCl_3 + 3H_2\)
Theo PTHH : \(n_{Zn} = n_{H_2} = \dfrac{6,72}{22,4} = 0,3(mol)\)
\(\Rightarrow n_{Fe_2O_3} = \dfrac{35,5-0,3.65}{160} = 0,1\\ \Rightarrow n_{HCl} = 2n_{Zn} + 6n_{Fe_2O_3} = 0,3.2 + 0,1.6 = 1,2(mol)\\ \Rightarrow m_{HCl} = 1,2.36,5 = 43,8(gam)\)
b)
\(CuO + H_2 \xrightarrow{t^o} Cu + H_2O\\ Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2Fe + 3H_2O\)
Gọi \(n_{CuO} = a;n_{Fe_2O_3} = b\)
\(\left\{{}\begin{matrix}80a+160b=19,6\\a+3b=0,3\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,135\\b=0,055\end{matrix}\right.\)
Vậy :
\(\left\{{}\begin{matrix}n_{Cu}=0,135\\n_{Fe}=0,055.2=0,11\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}m_{Cu}=0,135.64=8,64\left(gam\right)\\m_{Fe}=0,11.56=6,16\left(gam\right)\end{matrix}\right.\)

ta có nCO2=\(\frac{13.44}{22.4}\)=0,6 mol
bt1) Fe2O3+ CO\(\rightarrow\) CO2+Fe
ta có nFe= 0,6 mol
vậy mFe=0,6.56=33,6

1 ) CAO +H2O => CA(OH)2 (1)
2K + 2H2O => 2KOH + H2(2)
n (H2) =1,12/22,4 =0,05
theo ptpư 2 : n(K) = 2n (h2) =2.0.05=0,1(mol)
=> m (K) =39.0,1=3,9 (g)
% K= 3,9/9,5 .100% =41,05%
%ca =100%-41,05%=58,95%
xo + 2hcl =>xcl2 +h2o
10,4/X+16 15,9/x+71
=> giải ra tìm đc X bằng bao nhiêu thì ra

\(m_{CO_2}=\dfrac{3,36}{22,4}.44=6,6(g)\)
Áp dụng định luật BTKL: \(m_{\text{hh muối}}=m_{\text{hh oxit}}+m_{CO_2}=76+6,6=82,6(g)\)
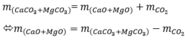
Câu 3:
PTPƯ: 1.\(Zn+H_2SO_4\rightarrow H_2+ZnSO_4\)
\(2.Mg+2HCl\rightarrow H_2+MgCl_2\)
\(3.Fe_2O_3+3H_2SO_4\rightarrow3H_2O+Fe_2\left(SO_4\right)_3\)
tự làm đi :D