Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Xem hỗn hợp ban đầu được tạo thành từ: Fe, Cu và O2
Fe -------> Fe3+ + 3e
x.........................3x
Cu -------> Cu2+ + 2e
y..........................2y
O2 + 4e -----> 2O2-
z.........4z
S+6 + 2e -------> S+4
...........0,045..........0,0225
Gọi x, y, z là số mol Fe, Cu, O2. Ta có hệ gồm 3 pt:
56x + 64y + 32z = 2,44
3x + 2y = 4z + 0,045
0,5*400x + 160y = 6,6
=> x = 0,025, y = 0,01, z = 0,0125
=> %mCu = 0,01*64/2,44*100% = 26,23%

Bài 1:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
gọi số mol của Fe phản ứng với một số mol của ACl2 là x
khối lương thanh sắt sau phản ứng là:11,2 - 56x + xMA = 12
=> x =
Ta có:
= 0,25.0,4 = 0,1 (mol)
=> MA = 64 g/mol; Vậy kim loại A là Cu
= nCu =
= 0,2 (mol) =>
= 0,5M
bài 2:
(C17H35COO)3C3H5 + 3NaOH -> 3 C17H35COONa + C3H5(OH)3
890 kg 918 kg
x kg 720 kg
=> x = 698,04 kg.

Bạn bấn vào đây, có người hỏi bài này rồi nhá Câu hỏi của Mạc Nhược Ca - Hóa học lớp 12 | Học trực tuyến

3.NO2 nhé
nNO2= 0,06 mol
PTHH:
Cu + 4HNO3→ Cu(NO3)2 + 2NO2+ 2H2O
x__________________________2x
Al+ 6HNO3→ Al(NO3)3+3NO2+3H2O
y______________________3y
Giải HPT:
\(\left\{{}\begin{matrix}64x+27y=1,23\\2x+3y=0,06\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=,015\\y=0,01\end{matrix}\right.\)
%Cu=\(\frac{0,015.64}{1,23}\text{.100%=78,048 %}\)
1.
Gọi số mol Mg và Al là a và b
nH2=0,4
Mg+2HCl\(\rightarrow\)MgCl2+H2
2Al+6HCl\(\rightarrow\)2AlCl3+3H2
Giải HPT:\(\left\{{}\begin{matrix}\text{ 24a+27b=7,8}\\\text{a+1,5b=0,4}\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,2\end{matrix}\right.\)
\(\rightarrow\)%mMg=\(\frac{0,1.24}{7,8}\)=30,77%
2.
Gọi số mol Zn, Al là a và b
3Zn+8HNO3\(\rightarrow\)3Zn(NO3)2+2NO+4H2O
Al+4HNO3\(\rightarrow\)Al(NO3)3+NO+2H2O
nNO=0,4
Giải HPT:
\(\left\{{}\begin{matrix}\text{65a+27b=11,9}\\\frac{2a}{3}\text{+b=0,4}\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}a=\frac{11}{470}\\\frac{271}{705}\end{matrix}\right.\)
\(\rightarrow\)%mZn=\(\frac{65.\frac{11}{470}}{11,9}\)=12,78%
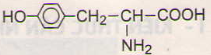 với các chất sau:
với các chất sau:
Lượng khí hidro thoát ra là 0,15 mol.
a) Al2O3 + 2NaOH \(\rightarrow\) 2NaAlO2 + H2O
2Al + 2NaOH + 2H2O \(\rightarrow\) 2NaAlO2 + 3H2.
b) Lượng Al phản ứng bằng 2/3 số mol khí hidro thoát ra và bằng 0,1 mol.
\(\Rightarrow\) %mnhôm=\(\dfrac{27.0,1}{12,9}\).100%\(\approx\)20,93%, %mnhôm oxit\(\approx\)100%-20,93%\(\approx\)79,07%.