Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Hòa tan hỗn hợp 1,69g Oleum có công thức H2SO4.3SO3 vào nước dư. Trung hòa dung dịch thu được Vml dung dịch KOH 1M. Giá trị của V là:
A.20
B.40
C.30
D.10
Giải thích:
\(H2SO4.3SO3+H2O=4H2SO4\)
\(n\left(o\le um\right)=0.005mol\)
\(\Rightarrow nH2SO4=0.005.4=0.02mol\)
\(H2SO4+2KOH=K2SO4+H2O\)
\(\Rightarrow nKOH=0.04\)
\(\Rightarrow\) Giá trị của V là: 40

Gọi x,y lần lượt là số mol của Zn và Al
Theo đề ta có mHỗnhợp=65x+27y=9,2(1)
nSO2=5,6:22,4=0,25mol
BTE:2x+3y=2.0,25=0,5(2)
Từ (1) và (2) => x=0,1;y=0,1
mAl=0,1.27=2,7g
Gọi x,y lần lượt là số mol của Zn và Al
Theo đề ta có mHỗnhợp=65x+27y=9,2(1)
nSO2=5,6:22,4=0,25mol
BTE:2x+3y=2.0,25=0,5(2)
Từ (1) và (2) => x=0,1;y=0,1
mAl=0,1.27=2,7g
Chúc bạn học tốt!!!

\(a.2Fe+6H_2SO_{4\left(đặc\right)}\rightarrow\left(t^o\right)Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\\ n_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ n_{Fe}=\dfrac{2}{3}.0,15=0,1\left(mol\right)\\ n_{Fe_2\left(SO_4\right)_3}=\dfrac{0,15}{3}=0,05\left(mol\right)\\ a,m=m_{Fe}=0,1.56=5,6\left(g\right)\\ b,m_{Fe_2\left(SO_4\right)_3}=400.0,05=20\left(g\right)\)

áp dụng công thức
v = ΔC\Δt = 0,22 - 0,1 \ 4 = 0,03 (M\s)�‾=Δ�Δ�=0,22−0,14=0,03(��)

Đáp án:
8,625 g
Giải thích các bước giải:
nCl2=22,4/22,4=1 mol
nNaOH=0,1x2=0,2 mol
nCa(OH)2=0,1x0,5=0,05 mol
2NaOH+Cl2->NaCl+NaClO+H2O
0,2 0,1 0,1
2Ca(OH)2+2Cl2->CaCl2+Ca(ClO)2+2H2O
0,05 0,05 0,025
m=0,025x111+0,1x58,5=8,625 g

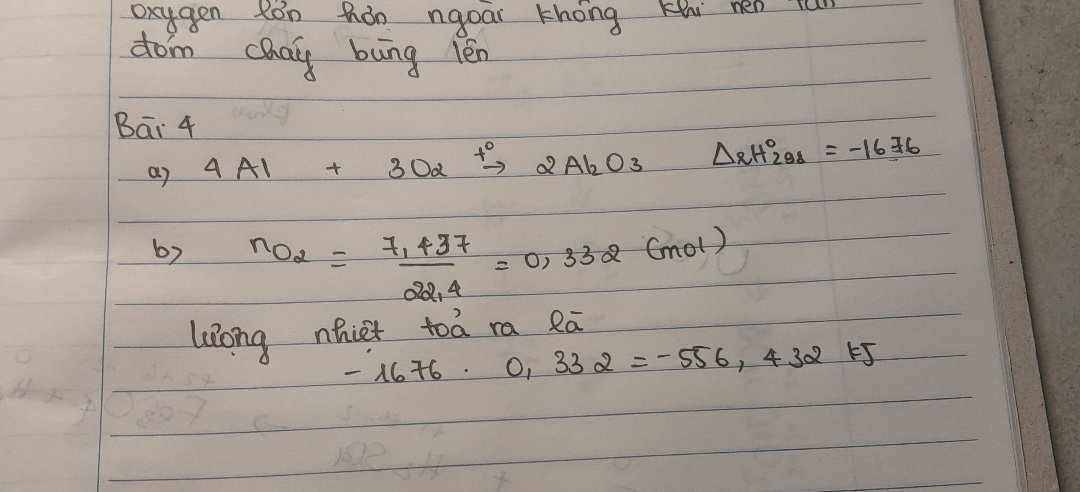
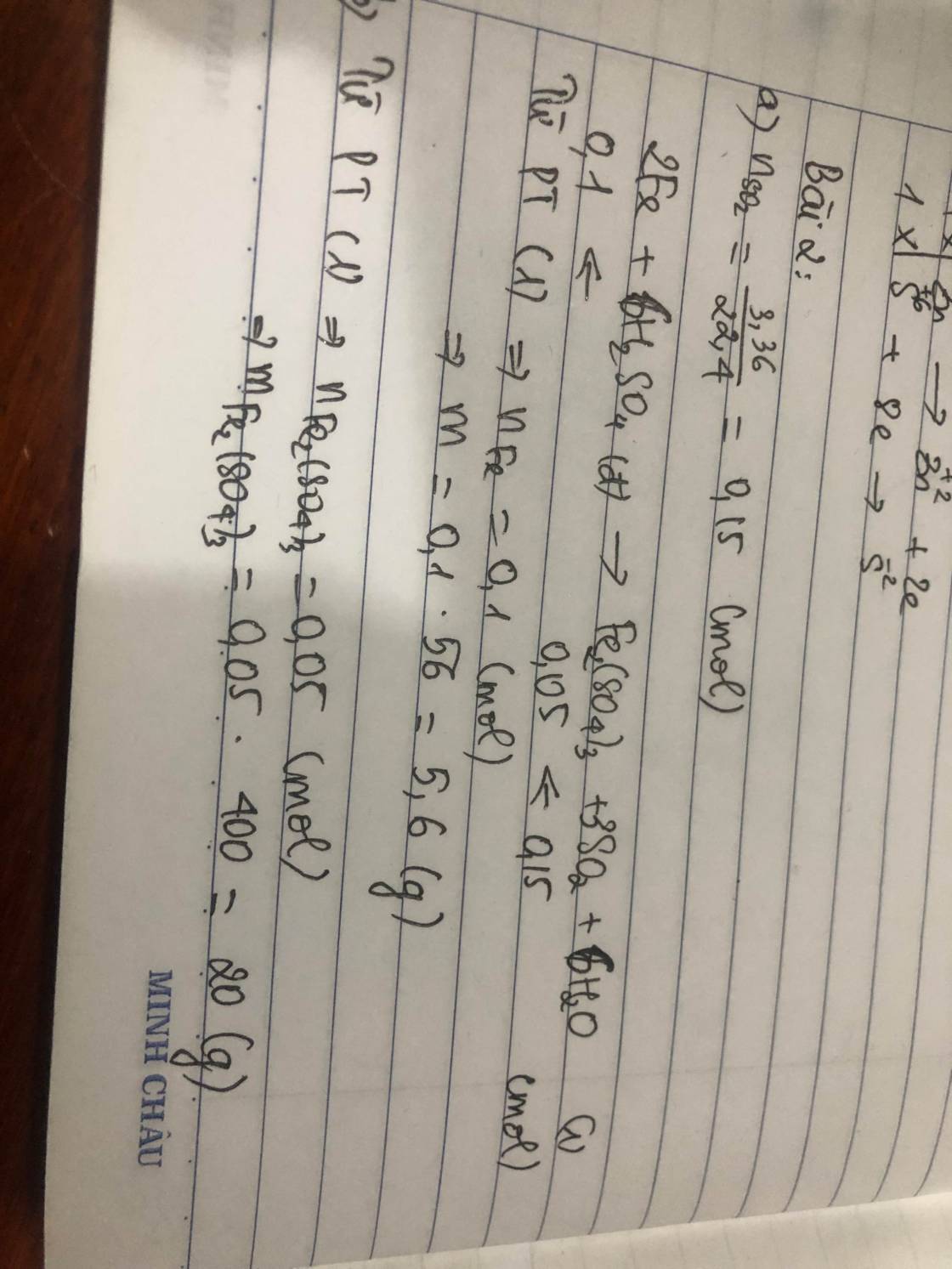
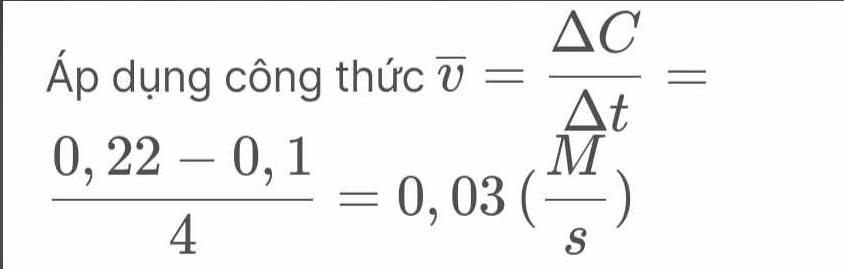


$n_X = 0,1 + 0,15 + 0,02 = 0,27(mol)$
$m_X = 0,1.2 + 0,15.30 + 0,02.64 = 5,98(gam)$
$M_X = 5,98 : 0,27 = 22,15(g/mol)$
$d_{X/H_2} = 22,15 : 2 = 11,08$
Đáp án B
hay quá