Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(1,2H_2+O_2\underrightarrow{t}2H_2O\)
\(2Mg+O_2\underrightarrow{t}2MgO\)
\(2Cu+O_2\underrightarrow{t}2CuO\)
\(S+O_2\underrightarrow{t}SO_2\)
\(4Al+3O_2\underrightarrow{t}2Al_2O_3\)
\(C+O_2\underrightarrow{t}CO_2\)
\(4P+5O_2\underrightarrow{t}2P_2O_5\)
\(2,PTHH:C+O_2\underrightarrow{t}CO_2\)
\(a,n_{O_2}=0,2\left(mol\right)\Rightarrow n_{CO_2}=0,2\left(mol\right)\Rightarrow m_{CO_2}=8,8\left(g\right)\)
\(b,n_C=0,3\left(mol\right)\Rightarrow n_{CO_2}=0,3\left(mol\right)\Rightarrow m_{CO_2}=13,2\left(g\right)\)
c, Vì\(\frac{0,3}{1}>\frac{0,2}{1}\)nên C phản ửng dư, O2 phản ứng hết, Bài toán tính theo O2
\(n_{O_2}=0,2\left(mol\right)\Rightarrow n_{CO_2}=0,2\left(mol\right)\Rightarrow m_{CO_2}=8,8\left(g\right)\)
\(3,PTHH:CH_4+2O_2\underrightarrow{t}CO_2+2H_2O\)
\(C_2H_2+\frac{5}{2}O_2\underrightarrow{t}2CO_2+H_2O\)
\(C_2H_6O+3O_2\underrightarrow{t}2CO_2+3H_2O\)
\(4,a,PTHH:4P+5O_2\underrightarrow{t}2P_2O_5\)
\(n_P=1,5\left(mol\right)\Rightarrow n_{O_2}=1,2\left(mol\right)\Rightarrow m_{O_2}=38,4\left(g\right)\)
\(b,PTHH:C+O_2\underrightarrow{t}CO_2\)
\(n_C=2,5\left(mol\right)\Rightarrow n_{O_2}=2,5\left(mol\right)\Rightarrow m_{O_2}=80\left(g\right)\)
\(c,PTHH:4Al+3O_2\underrightarrow{t}2Al_2O_3\)
\(n_{Al}=2,5\left(mol\right)\Rightarrow n_{O_2}=1,875\left(mol\right)\Rightarrow m_{O_2}=60\left(g\right)\)
\(d,PTHH:2H_2+O_2\underrightarrow{t}2H_2O\)
\(TH_1:\left(đktc\right)n_{H_2}=1,5\left(mol\right)\Rightarrow n_{O_2}=0,75\left(mol\right)\Rightarrow m_{O_2}=24\left(g\right)\)
\(TH_2:\left(đkt\right)n_{H_2}=1,4\left(mol\right)\Rightarrow n_{O_2}=0,7\left(mol\right)\Rightarrow m_{O_2}=22,4\left(g\right)\)
\(5,PTHH:S+O_2\underrightarrow{t}SO_2\)
\(n_{O_2}=0,46875\left(mol\right)\)
\(n_{SO_2}=0,3\left(mol\right)\)
Vì\(0,46875>0,3\left(n_{O_2}>n_{SO_2}\right)\)nên S phản ứng hết, bài toán tính theo S.
\(a,\Rightarrow n_S=n_{SO_2}=0,3\left(mol\right)\Rightarrow m_S=9,6\left(g\right)\)
\(n_{O_2}\left(dư\right)=0,16875\left(mol\right)\Rightarrow m_{O_2}\left(dư\right)=5,4\left(g\right)\)
\(6,a,PTHH:C+O_2\underrightarrow{t}CO_2\)
\(n_{O_2}=1,5\left(mol\right)\Rightarrow n_C=1,5\left(mol\right)\Rightarrow m_C=18\left(g\right)\)
\(b,PTHH:2H_2+O_2\underrightarrow{t}2H_2O\)
\(n_{O_2}=1,5\left(mol\right)\Rightarrow n_{H_2}=0,75\left(mol\right)\Rightarrow m_{H_2}=1,5\left(g\right)\)
\(c,PTHH:S+O_2\underrightarrow{t}SO_2\)
\(n_{O_2}=1,5\left(mol\right)\Rightarrow n_S=1,5\left(mol\right)\Rightarrow m_S=48\left(g\right)\)
\(d,PTHH:4P+5O_2\underrightarrow{t}2P_2O_5\)
\(n_{O_2}=1,5\left(mol\right)\Rightarrow n_P=1,2\left(mol\right)\Rightarrow m_P=37,2\left(g\right)\)
\(7,n_{O_2}=5\left(mol\right)\Rightarrow V_{O_2}=112\left(l\right)\left(đktc\right)\);\(V_{O_2}=120\left(l\right)\left(đkt\right)\)
\(8,PTHH:C+O_2\underrightarrow{t}CO_2\)
\(m_C=0,96\left(kg\right)\Rightarrow n_C=0,08\left(kmol\right)=80\left(mol\right)\Rightarrow n_{O_2}=80\left(mol\right)\Rightarrow V_{O_2}=1792\left(l\right)\)
\(9,n_p=0,2\left(mol\right);n_{O_2}=0,3\left(mol\right)\)
\(PTHH:4P+5O_2\underrightarrow{t}2P_2O_5\)
Vì\(\frac{0,2}{4}< \frac{0,3}{5}\)nên P hết O2 dư, bài toán tính theo P.
\(a,n_{O_2}\left(dư\right)=0,05\left(mol\right)\Rightarrow m_{O_2}\left(dư\right)=1,6\left(g\right)\)
\(b,n_{P_2O_5}=0,1\left(mol\right)\Rightarrow m_{P_2O_5}=14,2\left(g\right)\)

\(n_{hhkhí}=\dfrac{16,8}{22,4}=0,75\left(mol\right)\)
Gọi \(n_{SO_2}=a\left(mol\right)\left(0< a< 0,75\right)\)
\(\rightarrow n_{O_2\left(dư\right)}=0,75-b\left(mol\right)\)
Ta có: \(\dfrac{64a+32\left(0,75-a\right)}{0,75}=\dfrac{33,6}{1}=33,6\left(\dfrac{g}{mol}\right)\)
\(\rightarrow a=0,0375\left(mol\right)\)
\(\rightarrow\left\{{}\begin{matrix}\%V_{SO_2}=\dfrac{0,0375}{0,75}=5\%\\\%V_{O_2\left(dư\right)}=100\%-5\%=95\%\end{matrix}\right.\)

a/ Tại sao phải hơ cho natri cháy ngoài không khí rồi mới đưa nhanh vào bình ? tạo nhiệt độ pứ cháy b/ Sự cháy của natri trong không khí hay trong khí oxi xảy ra mãnh liệt hơn ? Tại sao ? vì O2 trong bình có nồng độ cao hơn thì hiệu suất sẽ tăng nên pứ nhanh hơn 4Na+O2-to>2Na2O c/ Sau phản ứng, người ta hòa tan sản phẩm vào nước trong bình, rồi thả mẩu quỳ tím vào dung dịch tạo thành. Cho biết màu của quỳ tím biến đổi thế nào ? quỳ chuyển xanh Na2O+H2O->2NaOH |
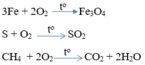
Câu 2 : Trong phòng thí nghiệm người ta thu khí oxi bằng phương pháp dời nước là do
A. Oxi nặng hơn nước B. Oxi tan ít và không phản ứng với nước
C, Oxi nhẹ hơn nước D, Oxi tan nhiều và không phản ứng với nước
Câu 3 : Nhóm các chất đều tác dụng với oxi trong điều kiện thích hợp là
A. S , P , NaCl B. H2, Fe , Au C. Mg , C , CH4 D. C ,S , CaCO3
--
Mg + 1/2 O2 -to-> MgO
C + O2 -to-> CO2
CH4 + 2 O2 -to-> CO2 + 2 H2O
Câu 4 : Lưu huỳnh cháy trong không khí là do :
A. Lưu huỳnh tác dụng với khí cacbon đioxit B. Lưu huỳnh tác dụng với oxi , nitơ
C. Lưu huỳnh tác dụng với khí nitơ D. Lưu huỳnh tác dụng với oxi (S+ O2 -to-> SO2)
Câu 5 : Một mol XO2 có khối lượng bằng hai lần khối lượng mol oxi . Nguyên tố X đó là :
A. S B. C C. N D. Si
M(XO2)= 2. M(O2)= 2.32= 64(g/mol)
Mặt khác: M(XO2)= M(X)+32(g/mol)
=> M(X)+32=64 (g/mol)
=>M(X)= 32(g/mol)=>X là lưu huỳnh (S=32)
Câu 6 : Cho các công thức hóa học sau : 1. SO2, 2. NO , 3.K2O , 4. CO2 , 5. N2O5 , 6. Fe2O3 , 7. CuO , 8. P2O5 , 9. CaO , 10. SO3
a, Những chất nào thuộc loại oxit axit
A, 1,2,3,4,6,9 B. 1,4,5,8,10 C. 1,2,4,5,7,10 D. 2,3,6,8,9,10
b, Những chất nào thuộc loại oxit bazơ
A. 3,6,7,9,10 B. 3,4,5,6 C. 1,2,4,6 D. Tất cả đều sai