
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


1 đốt
2 cô cạn
3 2,3
4 hạt proton
5 đơn vị cacbon ( đvc )
6 proton electron
7 electron
8 4 . 48335 x 10-23
9 số hạt proton bằng số hạt electron
10 vì khối lượng của electron ko đáng kể
11 proton , nơtron , electron
12 có cùng số proton trog hạt nhân (các nguyên tử cùng loại )
13 sắt , chì , kẽm , thủy ngân
14 Oxi , nitơ , cacbon , clo
15 2 đơn chất 4 hợp chất
16 Fe , O2 , Cl2 , P , Na
17 Na2O , HNO3 , CO2 , CaO , BaCl2
18 342 đvc
19 2O2
20 HNO3
21 P2O5
22 2 nguyên tử Al , 3 nguyên tử S , 4 nguyên tử O
23 CaO , Al2O3 , K2OO
24 Ba3 (PO4)2
25 CO3
26 XY
27 X3Y2
bn nhé

a) Vì bên trái có tổng số nguyên tử H = tổng số nguyên tử H bên phải
nhưng bên tráicó tổng số nguyên tử O > tổng số nguyên tử O bên phải
Cách thăng bằng : Thêm vào bên phải 1 nguyên tử O
b) Cách giải thích : tương tự câu a)
c) Số nguyên tử ở cả 2 phía cân hình 3 bằng nhau
=====> Cách viết PTHH
2H2 + O2 ===> 2H2O


haizz
dừ ước j đề cx dễ như rk m hè
khổ
t hc nát óc r` mà có vô dc j mô ![]()
![]()


b. P2O5 + 3H2O → 2H2PO4
Tỉ lệ 1 : 3 : 2
c. 2HgO → 2Hg + O2
Tỉ lệ 2 : 2 : 1
d. Fe(OH)3 → Fe2O3 + 3H2O
Tỉ lệ 1 : 1 : 3
e. NaCO3 + CaCl2 → CaCO3 + 2NaCl
Tỉ lệ 1 : 1 : 1 : 2
Bài 3:
D. Mg(OH)2 → MgO + H2O là phương trình hóa học cân bằng đúng.

a. O2 + 2CuO → 2CuO
b. N2 + 3H2 → 2NH3
c. 2Fe + 2HCl → FeCl2 + H2
d. Mg(OH)2 → MgO + H2O

Đây là trang hoc, bạn làm ơn đừng đăng mấy cái ảnh lên , nó làm loạn cả trang lên đấy

a, có đếm đc, vì ta có thể nhìn thấy chúng
b, ko đếm đc, vì nó quá nhỏ, mắt thường ko thể nhìn thấy
còn mấy câu khác phải học mol mới giải đc vs lại mới hđ khởi đông nên thôi

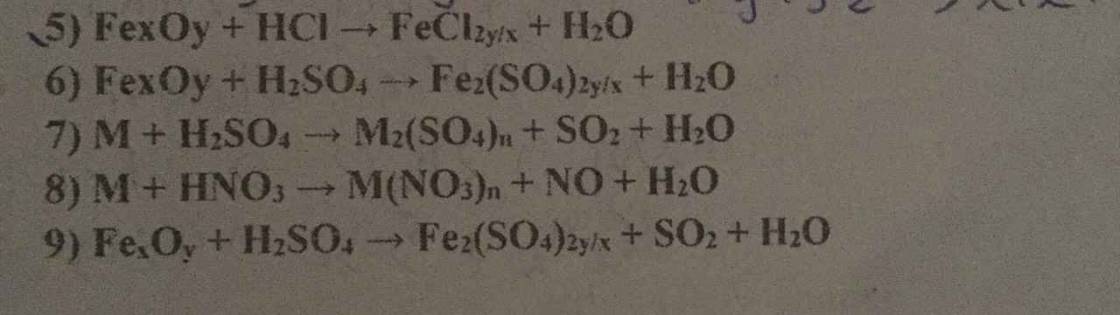


















 A) tại sao cân lệch về phía bên trái hình 1
A) tại sao cân lệch về phía bên trái hình 1



 Đề cg hóa
Đề cg hóa





 help
help


 VV
VV


5. \(Fe_xO_y+2yHCl\rightarrow xFeCl_{\dfrac{2y}{x}}+yH_2O\)
6. \(2Fe_xO_y+2yH_2SO_4\rightarrow xFe_2\left(SO_4\right)_{\dfrac{2y}{x}}+2yH_2O\)
7. \(2M+2nH_2SO_4\rightarrow M_2\left(SO_4\right)_n+nSO_2+2nH_2O\)
8. \(3M+4nHNO_3\rightarrow3M\left(NO_3\right)_n+nNO+2nH_2O\)
9. Phần này bạn xem lại đề nhé, nếu có SO2 thì muối thu được không thể là Fe2(SO4)2y/x được.