Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Số mol của đồng
nCu = \(\dfrac{m_{Cu}}{M_{Cu}}=\dfrac{25,6}{64}=0,4\left(mol\right)\)
Số mol của khí oxi ở dktc
nO2 = \(\dfrac{V_{O2}}{22,4}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Pt : 2Cu + O2 →(to) 2CuO\(|\)
2 1 2
0,4 0,1 0,2
Lập tỉ số so sánh : \(\dfrac{0,4}{2}>\dfrac{0,1}{1}\)
⇒ CuO dư , O2 phản ứng hết
⇒ Tính toán dựa vào số mol của O2
Số mol của đồng (II) oxit
nCuO= \(\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
Khối lượng của đồng (II) oxit
mCuO = nCuO . MCuO
= 0,2. 80
= 16 (g)
Số mol dư của đồng
ndư = nban đầu - nmol
= 0,4 - (0,2 . 2)
= 0,2 (mol)
Khối lượng dư của đồng
mdư = ndư . MCu
= 0,2 . 64
= 12,8 (g)
Chúc bạn học tốt
\(n_{Cu}=0,4\left(mol\right)\)
\(n_{O_2}=0,1\left(mol\right)\)
\(2Cu+O_2\underrightarrow{t^o}2CuO\)
\(\dfrac{n_{Cu}}{2}=\dfrac{0,4}{2}=0,2>0,1=\dfrac{0,1}{1}=\dfrac{n_{O_2}}{1}\)
=> Cu dư, O2 hết => tính theo O2
\(2Cu+O_2\underrightarrow{t^o}2CuO\)
0,2-------0,1-----0,2 (mol)
\(m_{CuO}=0,2.80=16\left(g\right)\)
\(m_{Cu_{dư}}=\left(0,4-0,2\right).64=12,8\left(g\right)\)


Bài 1
Coi khối lượng Fe:7 gam
Khối lượng O:3 gam
-> nFe=7:56=0,125 mol
no=3:16=0,1875 mol
Tỉ lệ nFe:no=o,125:0,1875=2:3
->công thức:Fe2O3
b khối lượng mol là:
56* 2+16*3=160


\(\dfrac{2A}{2A+16.5}=\dfrac{43,66}{100}\)
=> \(200A=43,66.\left(2A+16.5\right)\)
=> \(200A-87,32A=3492,8\)
=> \(112,68A=3492,8\)
=> A= 31

Câu 4:
4.1/ Ta có: \(n_{NaCl}=2,5.0,4=1\left(mol\right)\)
\(\Rightarrow m_{NaCl}=1.58,5=58,5\left(g\right)\)
4.2/ Ta có: \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
_____0,2___________0,2____0,2 (mol)
b, \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
c, \(m_{ZnCl_2}=0,2.136=27,2\left(g\right)\)
Bạn tham khảo nhé!

 Mn ơi, giải hộ mik câu này với! Tối nay mik phải nộp rồi ạ! Cảm ơn mn nhiều lắm!
Mn ơi, giải hộ mik câu này với! Tối nay mik phải nộp rồi ạ! Cảm ơn mn nhiều lắm!







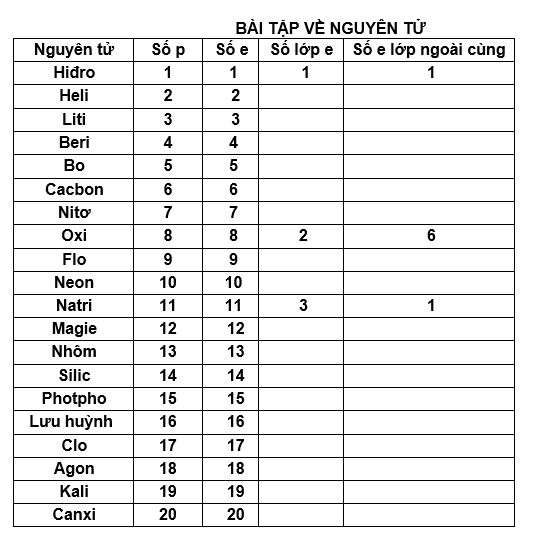
a.b.\(n_P=\dfrac{m_P}{M_P}=\dfrac{6,2}{31}=0,2mol\)
\(n_{O_2}=\dfrac{V_{O_2}}{22,4}=\dfrac{6,72}{22,4}=0,3mol\)
\(4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\)
0,2 < 0,3 ( mol )
0,2 0,25 0,1 ( mol )
Chất còn dư là O2
\(V_{O_2\left(dư\right)}=n_{O_2\left(dư\right)}.22,4=\left(0,3-0,25\right).22,4=1,12l\)
\(m_{P_2O_5}=n_{P_2O_5}.M_{P_2O_5}=0,1.142=14,2g\)
c.\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
1/6 0,25 ( mol )
\(m_{KClO_3}=n_{KClO_3}.M_{KClO_3}=\dfrac{1}{6}.122,5=20,41g\)
a) PTHH: \(4P+5O_2\rightarrow^{t^0}2P_2O_5\)
b) \(n_P=\dfrac{m}{M}=\dfrac{6,2}{31}=0,2\left(mol\right);n_{O_2}=\dfrac{V}{22,4}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(4P+5O_2\rightarrow^{t^0}2P_2O_5\)
4 : 5 : 2
0,2 : 0,3
-So sánh tỉ lệ: \(\dfrac{0,2}{4}< \dfrac{0,3}{5}\)
\(\Rightarrow\)P phản ứng hết còn O2 dư.
\(m_{O_2\left(dư\right)}=16.0,3-16.\dfrac{0,2.5}{4}=0,8\left(g\right)\)
c) -Theo PTHH trên:
\(n_{P_2O_5}=\dfrac{0,2.2}{4}=0,1\left(mol\right)\)
\(\Rightarrow m_{P_2O_5}=n.M=142.0,1=14,2\left(g\right)\)
d) -Theo PTHH trên:
\(n_{O_2\left(LT\right)}=\dfrac{0,2.5}{4}=0,25\left(mol\right)\)
PTHH: \(2KClO_3\rightarrow^{t^0}2KCl+3O_2\uparrow\)
2 : 2 : 3
\(\dfrac{1}{6}\) : \(\dfrac{1}{6}\) : 0,25
\(\Rightarrow m_{KClO_3}=n.M=\dfrac{1}{6}.122,5=\dfrac{245}{12}\left(g\right)\)