Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Trích mẫu thử:
Dùng nước bromine, mẫu thử nào thấy nước bromine mất màu là: styrene
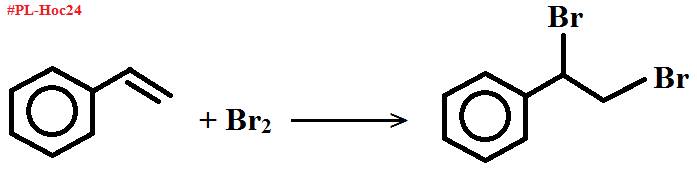
Hai mẫu thử còn lại, nhỏ dd KMnO4, đun nóng.
Nếu dd KMnO4 mất màu và xuất hiện kết tủa đen là toluene.
\(C_6H_5CH_3+2KMnO_4\xrightarrow[]{t^\circ}C_6H_5COOK+KOH+2MnO_2\downarrow+H_2O\)
Không hiện tượng là benzene.

Các số oxi hóa có thể có của sulfur: -2; 0; +2; +4; +6.
Vì +6 là số oxi hóa lớn nhất của sulfur, do đó trong các phản ứng oxi hóa khử, số oxi hóa của sulfur chỉ có thể giảm về +4 (hoặc +2; 0; -2). Vậy H2SO4 không có khả năng thể hiện tính khử, mà chỉ thể hiện tính oxi hóa.

- Benzene phản ứng với Br2 trong điều kiện đun nóng và có xúc tác FeBr3.
- Phenol phản ứng với Br2 ngay điều kiện thường và không cần chất xúc tác.
=> Điều này đã chứng minh rằng ảnh hưởng của nhóm – OH, phản ứng thế nguyên tử hydrogen ở vòng benzene của phenol xảy ra dễ dàng hơn so với benzene.

NH4NO2 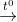 N2 + 2H2O; NH4NO3
N2 + 2H2O; NH4NO3 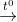 N2O + 2H2O
N2O + 2H2O
N có số oxi hóa +3 và +5 trong NO2- và NO3- : đóng vai trò chất oxi hóa.
N có số oxi hóa -3 trong NH4+: đóng vai trò chất khử.

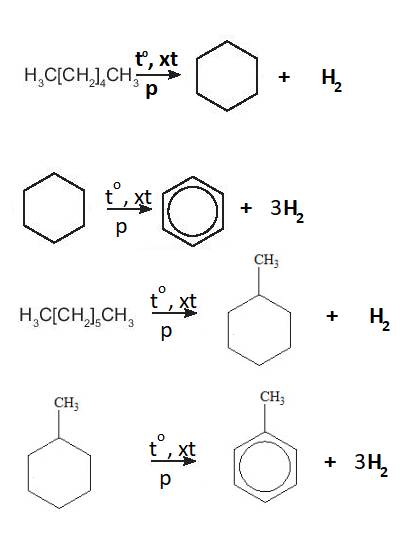
Toluene có khả năng bị oxi hóa bởi `KMnO_4`
PTHH: \(2KMnO_4+C_6H_5CH_3\rightarrow C_6H_5COOK+2MnO_2+KOH+H_2O\)