Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

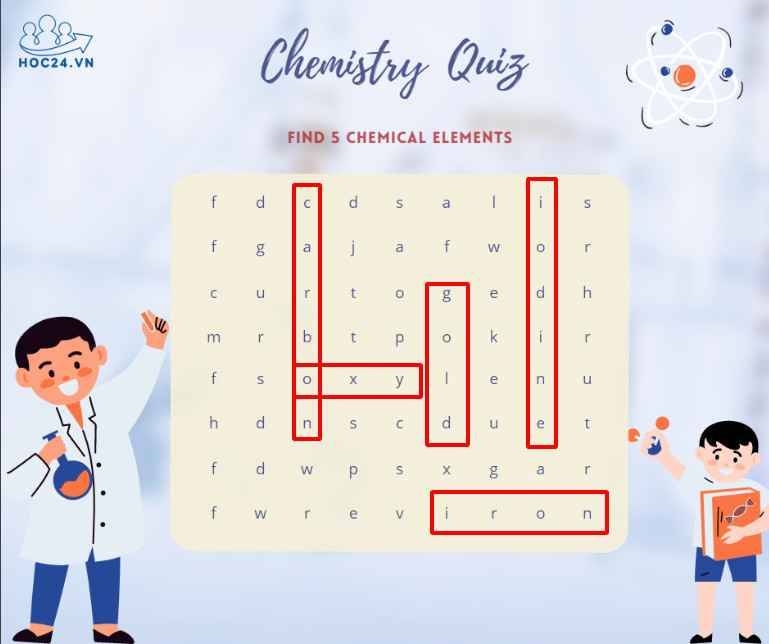
*cái oxy em k chắc á cô:<< em tìm được mấy nguyên tố này th ạ:<.

alo giúp mik Nhân dịp đi du lịch về, Mai mang đến lớp 51 móc chìa khóa để tặng cho cácbạn. Sau khi chia hết cho các bạn (tính cả mình) thì Mai còn thừa3chiếc. Hỏi lớpMai có bao nhiêu bạn, biết số học sinh nhiều hơn 20 và ít hơn 30 bạn.

Câu 3:
N2+O2\(\overset{t^0}{\rightarrow}\)2NO
4NO+3O2+2H2O\(\rightarrow\)4HNO3
NO3- : làm tăng lượng phân đạm cho cây!

12.
Na2CO3+H2SO4->Na2SO4+H2O+CO2
............. 0,5 ............. ......... 0,5
CO2+2KOH->K2CO3+H2O
x 2x x
CO2+KOH->KHCO3
y y y
mKOH=98.40/100=39,2g
nKOH=39,2/56=0,7mol
Có:
2x+y=0,7
138x+100y=57,6
=>x=0,2mol; y=0,3mol
mK2CO3=138.0,2=27,6g
mKHCO3=57,6-27,6=30g
b.
nCO2=x+y=0,2+0,3=0,5mol
CMddH2SO4=0,5/0,2=2,5M
8. Hoàn thành sơ đồ chuyển hóa sau:
Mg \(\underrightarrow{\left(1\right)}\) MgO \(\underrightarrow{\left(2\right)}\) MgCl2 \(\underrightarrow{\left(3\right)}\) Mg(OH)2 \(\underrightarrow{\left(4\right)}\) MgO \(\underrightarrow{\left(5\right)}\) MgSO4 \(\underrightarrow{\left(6\right)}\) MgCO3 \(\underrightarrow{\left(7\right)}\) MgO
\(\left(1\right)2Mg+O_2\underrightarrow{t^o}2MgO\)
\(\left(2\right)MgO+2HCl\rightarrow MgCl_2+H_2O\)
\(\left(3\right)MgCl_2+2NaOH\rightarrow Mg\left(OH\right)_2\downarrow+2NaCl\)
\(\left(4\right)Mg\left(OH\right)_2\underrightarrow{t^o}MgO+H_2O\)
\(\left(5\right)MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
\(\left(6\right)MgSO_4+Na_2CO_3\rightarrow MgCO_3+Na_2SO_4\)
\(\left(7\right)MgCO_3\underrightarrow{t^o}MgO+CO_2\uparrow\)

1. a) Tên gọi của axit:
HNO3: axit nitric
HCl: axit clohidric
H2CO3: axit cacbonic
H2S: axit sunfuhidric
H2SO4: axit sunfuric
H2SO3: axit sunfurơ
Axit mạnh: HCl, HNO3, H2SO4...
Axit yếu: H2S, H2CO3...

12. Na2O + H2O ---> 2 NaOH
0,4 mol 0,8
CaCO3 ---> CaO + CO2
0,5 mol 0,5
CO2 + 2NaOH ---> Na2CO3 + H2O
0,4 0,8 mol 0,4
CO2 + Na2CO3 + H2O ---> 2NaHCO3
0,1 mol 0,1 0,2
=> Muối thu được có Na2CO3 0,4 - 0,1 = 0,3 mol và NaHCO3 0,2 mol
=> m Muối = 0,3. 106 + 0,2. 84 = 48,6g
11a. CO2 0,1 mol. NaOH 0,1 mol => Sản phẩm sau pư là NaHCO3 0,1 mol
=> m = 0,1.84 = 8,4g.
11b. SO2 0,5 mol. KOH 1,5 mol => Sau pư có K2SO3 0,5 mol và KOH dư 0,5 mol
=> mK2SO3 = 0,5. 158 = 79g và mKOH = 0,5. 56 = 28g.
11c. CO2 = 0,3 mol và Ca(OH)2 0,2 mol
=> sau pư có CaCO3 0,1 mol và Ca(HCO3)2 0,1 mol

1.(đề đầu)
1. SO3
2.\(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
3.\(CaO+2HCl\rightarrow CaCl_2+H_2O\)
2.
(1)\(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
(2)\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\)
(3)CaCO3 --nhiệt>CaO+H2O
(4)\(CaO+2HCl\rightarrow CaCl_2+H_2O\)
(5)\(3CaCl_2+2Na_3PO_4\rightarrow Ca_3\left(PO_4\right)_2+6NaCl\)
3.
a,\(SO_3+H_2O\rightarrow H_2SO_4\)
b,\(n_{SO_3}=\dfrac{8}{80}=0,1\left(mol\right)\)
Theo PTHH: \(n_{H2SO4}=n_{SO3}=0,1\left(mol\right)\)
\(\Rightarrow C_{M\left(SO3\right)}=\dfrac{0,1}{0,25}=0,4\left(M\right)\)
1(Đề 2)
1.H2SO4
2.BaO
3.CuO
2.
(1)CaCO3---nhiệt-->CaO+H2O
(2)CaO+H2O--->Ca(OH)2
(3)Ca(OH)2+CO2--->CaCO3+H2O
(4)CaO+2HCl--->CaCl2+H2O
(5)Ca(OH)2+Mg(NO3)2---->Ca(NO3)2+Mg(OH)2
3.
a, SO3+H2O--->H2SO4
b,\(n_{SO3}=\dfrac{16}{80}=0,2\left(mol\right)\)
Theo PTHH:\(n_{H2SO4}=n_{SO3}=0,2\left(mol\right)\)
\(\Rightarrow C_{M\left(H2SO4\right)}=\dfrac{0,2}{0,5}=0,4\left(mol\right)\)

(1)2Al+2H2O+ 2NaOH → 3H2 +NaAlO2
(2) 4Al + 3O2 → 2Al2O3
(3) 2Al2O3 → 4Al + 3O2
(4) 2Al+ 2H2O + 2NaOH→3H2 +2NaAlO2
(5) 2Al + 3CuCl2 → 2AlCl3 + 3Cu
(6) Al2O3 + 6HCl → 2AlCl3 + 3H2O
(7) Al2O3 + Na2CO3 → 2NaAlO2 + CO2
8)AlCl3+3NaOH→2H2O+3NaCl+NaAlO2
(9)4HCl + NaAlO2 →AlCl3 + 2H2O+NaCl
(10)AlCl3 + 3NaOH →Al(OH)3 + 3NaCl
(11)Al(OH)3 + NaOH →2 H2O + NaAlO2
(12)2Al(OH)3 → Al2O3 + 3H2O
oa đến đây thôi dài quá



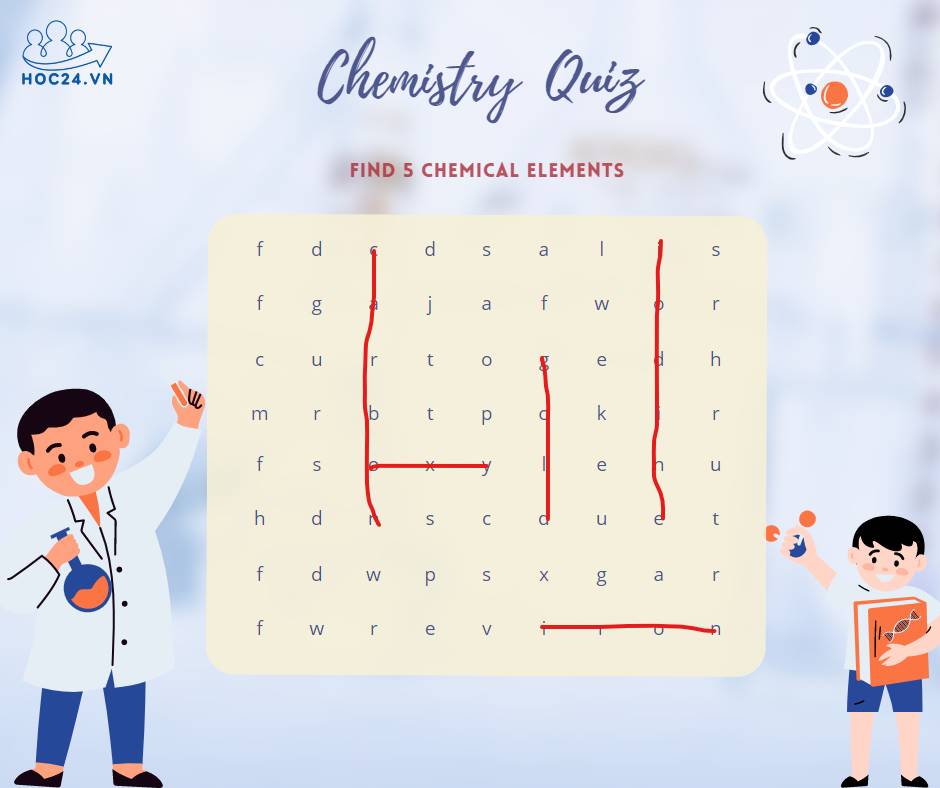


















 Giúp mình giải vài câu thực tế Hoá nha..
Giúp mình giải vài câu thực tế Hoá nha..

 Giúp hộ mình nha !!!
Giúp hộ mình nha !!! Cảm ơn bạn !!!
Cảm ơn bạn !!!
 giup mình với cảm ơn rất nhiều
giup mình với cảm ơn rất nhiều


 mn giúp e những câu còn lại ạ :)
mn giúp e những câu còn lại ạ :)
2
a) Chất rắn màu đen và xanh lơ tan dần, xuất hiện dung dịch mà xanh lam.
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\\ Cu\left(OH\right)_2+H_2SO_4\rightarrow CuSO_4+2H_2O\)
b) Chất rắn màu đỏ nâu tan dần, xuất hiện dung dịch màu vàng nâu.
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\\ Fe\left(OH\right)_3+3HCl\rightarrow FeCl_3+3H_2O\)
c) Dần dần xuất hiện kết tủa trắng.
\(H_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4+2H_2O\\ H_2SO_4+BaCl_2\rightarrow BaSO_4+2HCl\\ Ba\left(NO_3\right)_2+H_2SO_4\rightarrow BaSO_4+2HNO_3\\ Na_2SO_4+BaCl_2\rightarrow2NaCl+BaSO_4\\ Na_2SO_4+Ba\left(NO_3\right)_2\rightarrow2NaNO_3+BaSO_4\\ Na_2SO_4+Ba\left(OH\right)_2\rightarrow2NaOH+BaSO_4\)
\(3:\\ 1/Fe+2HCl\rightarrow FeCl_2+H_2\\ 2/2H_2SO_4+Cu\xrightarrow[t^0]{đặc}CuSO_4+SO_2+2H_2O\\ 3/Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\\ 4/SO_3+H_2O\rightarrow H_2SO_4\\ 5/Ba\left(NO_3\right)_2+H_2SO_4\rightarrow BaSO_4+2HNO_3\\ 6/H_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4+2H_2O\)