Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1. - Trích mẫu thử
- Cho quỳ tím vào các mẫu thử:
+ Nếu quỳ tím hóa đỏ là HCl
+ Nếu quỳ tím hóa xanh là NaOH và Ba(OH)2
+ Nếu quỳ tím không đổi màu là NaCl
- Cho H2SO4 vào 2 mẫu thử còn lại:
+ Nếu có kết tửa trắng là Ba(OH)2
\(Ba\left(OH\right)_2+H_2SO_4--->BaSO_4\downarrow+2H_2O\)
+ Nếu không có hiện tượng là NaOH
\(2NaOH+H_2SO_4--->Na_2SO_4+2H_2O\)
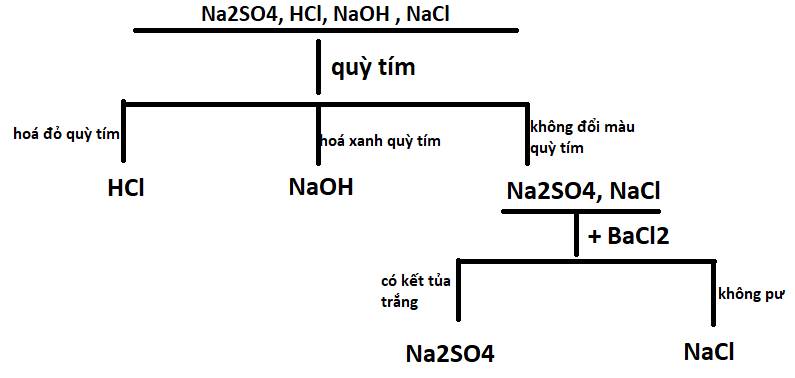
2. - Trích mẫu thử
- Cho quỳ tím vào các mẫu thử:
+ Nếu quỳ tím hóa đỏ là HCl
+ nếu quỳ tím không đổi màu là NaCl và Na2SO4
- Cho BaCl2 vào 2 mẫu thử còn lại:
+ Nếu có kết tủa trắng là Na2SO4
\(Na_2SO_4+BaCl_2--->BaSO_4\downarrow+2NaCl\)
+ Nếu không có hiện tượng là NaCl

- Cho các dd tác dụng với quỳ tím
+ QT chuyển xanh: NaOH
+ QT chuyển đỏ: HCl
+ QT không chuyển màu: NaNO3, NaCl
- Cho 2 dd còn lại tác dụng với dd AgNO3
+ Kết tủa trắng: NaCl
NaCl + AgNO3 --> AgCl\(\downarrow\) + NaNO3
+ Không hiện tượng: NaNO3

PTHH:
Na2SO4 + BaCl2 ----> BaSO4\(\downarrow\) + 2NaCl
**P/s: Có thể thay BaCl2 bằng Ba(OH)2, phản ứng vẫn xảy ra tương tự.
Na2SO4 + Ba(OH)2 ---> BaSO4\(\downarrow\) + 2NaOH
Chúc em học tốt!

a, - Trích mẫu thử.
- Nhỏ vài giọt từng mẫu thử vào giấy quỳ tím.
+ Quỳ hóa đỏ: HCl, H2SO4. (1)
+ Quỳ không đổi màu: Na2SO4.
- Cho mẫu thử nhóm (1) pư với dd BaCl2
+ Có tủa trắng: H2SO4
PT: \(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
+ Không hiện tượng: HCl.
- Dán nhãn.
b, - Trích mẫu thử.
- Nhỏ vài giọt từng mẫu thử vào giấy quỳ tím.
+ Quỳ hóa xanh: NaOH
+ Quỳ hóa đỏ: H2SO4
+ Quỳ không đổi màu: NaCl
- Dán nhãn.

hòa tan các chất vào H2O ta thu được cá dung dịch,trích mẫu thử dùng quỳ tím và dd Ba(OH)2
lấy 1 đến 2 ml các dd nhỏ vào giấy quỳ tím ta chia làm 2 nhóm:
Nhóm 1:quỳ tím từ màu tím chuyển thành màu đỏ gồm HCl và H2SO4
Nhóm 2:quỳ tím không đổi màu gồm NaCL và Na2SO4
cho nhóm 1 tác dụng với dd Ba(OH)2 nếu sau pư ở dd nào có chất rắn không tan và không bị phân hủy bởi nhiệt độ cao là BaSO4 của dd H2SO4 còn tạo dd không màu là BaCl2 của HCl
cho nhóm 2 tác dụng với dd Ba(OH)2 nếu dd nào thấy có chất rắn như khi cho nhóm 1 tác dung với Ba(OH)2 thì chất ban đầu đem pư là Na2SO4 còn không có hiện tượng gì là NaCl vì không pư với dd Ba(OH)2
-Cho quỳ tím vào 4 mẫu thử:
+Quỳ tím hóa đỏ\(\rightarrow\)HCl, H2SO4(nhóm I)
+Quỳ tím không đổi màu\(\rightarrow\)NaCl, Na2SO4(nhóm II)
-Cho dung dịch BaCl2 vào 2 mẫu nhóm I:
+Có kết tủa trắng\(\rightarrow\)H2SO4
BaCl2+H2SO4\(\rightarrow\)BaSO4\(\downarrow\)+2HCl
+Không hiện tượng\(\rightarrow\)HCl
-Cho dung dịch BaCl2 vào 2 mẫu nhóm II:
+Có kết tủa trắng\(\rightarrow\)Na2SO4
BaCl2+Na2SO4\(\rightarrow\)BaSO4\(\downarrow\)+2NaCl
+Không hiện tượng\(\rightarrow\)NaCl

Dùng quỳ tím để nhận biết
Trích mỗi chất 1 ít cho vào 3 ống nghiệm , sau đó cho giấy quỳ tím vào .
Ống nào làm quỳ tím chuyển thành màu đỏ là dd HCL . Ống nào làm quỳ tím chuyển thành màu xanh là dd KOH . Ống nào ko có hiện tượng gì là dd NaCL .

A) trích mẫu thử
cho 2 mẫu thư vào dung dịch AgNO3
+nếu có kết tủa trắng là HCl
pt HCL+AgNO3--->AgCl+HNO3
+ nếu không có hiện tương gì xảy ra là NA2SO4
CÂU B TƯƠNG TỰ CÂU A
- Trích mẫu thử
- Cho quỳ tím vào các mẫu thử:
+ Nếu quỳ tím hóa đỏ là HCl
+ Nếu quỳ tím hóa xanh là NaOH
+ Nếu quỳ tím không đổi màu là NaCl và Na2SO4
- Cho BaCl2 vào 2 mẫu thử còn lại:
+ Nếu có kết tửa trắng là Na2SO4
\(Na_2SO_4+BaCl_2--->BaSO_4\downarrow+2NaCl\)
+ Nếu không có hiện tượng là NaCl