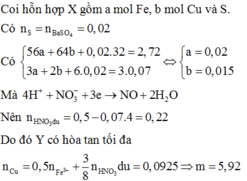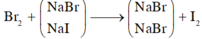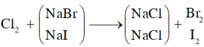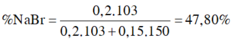Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1 :\(n_{CO_2} = \dfrac{2,688}{22,4} = 0,12(mol)\)
MgCO3 + 2HCl \(\to\) MgCl2 + CO2 + H2O
..................................0,12........0,12..................(mol)
Suy ra: a = 0,12.95 = 11,4(gam)
Câu 2 :
\(Fe + 2HCl \to FeCl_2 + H_2\\ n_{Fe} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)\\ \Rightarrow n_{Cu} = 2n_{Fe} = 0,15.2 = 0,3(mol)\\ 2Fe+3Cl_2\xrightarrow{t^o} 2FeCl_3\\ Cu+Cl_2 \xrightarrow{t^o} CuCl_2\\ n_{Cl_2} = \dfrac{3}{2}n_{Fe} + n_{Cu} = 0,525\\ \Rightarrow V = 0,525.22,4 =11,76(lít)\)

Đáp án D
Gọi số mol của Cu là a mol
Xét giai đoạn m gam Cu tác dụng với dung dịch HNO3:
Sơ đồ phản ứng:
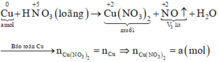
Các quá trình nhường, nhận electron:
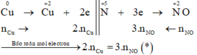
Xét giai đoạn m gam Cu tác dụng với H2SO4 đặc:
Sơ đồ phản ứng:
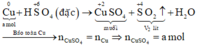
Các quá trình nhường, nhận electron:


- Gọi số mol Al và Fe trong hốn hợp lần lượt là a, b mol
PTKL : 27a + 56b = 22
BTe : 3a + 3b = 1,8
=> a = 0,4 và b = 0,2 .
=> mAl = 10,8g và mFe = 11,2 g
b, Sau phản ứng thu được muối Al2(SO4)3 và Fe2(SO4)3 .
=> mM = 108,4g
\(n_{Al}=a\left(mol\right),n_{Fe}=b\left(mol\right)\)
\(\Rightarrow27a+56b=22\left(1\right)\)
\(n_{SO_2}=\dfrac{20.16}{22.4}=0.9\left(mol\right)\)
\(2Fe+6H_2SO_{4\left(đ\right)}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
\(2Al+6H_2SO_{4\left(đ\right)}\rightarrow Al_2\left(SO_4\right)_3+3SO_2+6H_2O\)
\(n_{SO_2}=1.5a+1.5b=0.9\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.4,b=0.2\)
\(m_{Al}=0.4\cdot27=10.8\left(g\right)\)
\(m_{Fe}=11.2\left(g\right)\)
\(m_{Muối}=0.2\cdot342+0.1\cdot400=108.4\left(g\right)\)

Câu 1:
\(\left\{{}\begin{matrix}n_{Cu}=0,06\left(mol\right)\\n_{HNO3}=0,08\left(mol\right)\\n_{HCl}=0,08\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{H^+}=n_{HNO3}+n_{HCl}=0,16\left(mol\right)\)
\(n_{NO3^-}=n_{HNO3}=0,08\left(mol\right)\)
PTHH :
\(3Cu+8H^++2NO^-_3\rightarrow3Cu^{2+}+2NO+4H_2O\)
Theo PT , đề bài ta thấy Cu và H+ hết NO3− dư
\(\Rightarrow n_{NO}=\frac{2}{3}n_{Cu}=0,06.\frac{2}{3}=0,04\left(mol\right)\)
\(\Rightarrow V_{NO}=0,04.22,4=0,896\left(l\right)\)

Đáp án C
Quy đổi hỗn hợp về Fe (x mol); Cu (y mol) và S (z mol)
Bảo toàn S có
nS = n↓ = 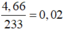 (mol)
(mol)
mX = 2,72 gam → 56x + 64y + 0,02.32 = 2,72 → 56x + 64y = 2,08 (1)
Do Y có thể hòa tan được Cu, bảo toàn electron có:
3.nFe + 2.nCu + 6.nS = 3.0,07 → 3x + 2y = 0,09 (2)
Từ (1) và (2) có: x = 0,02 và y = 0,015.
Dung dịch Y gồm: Fe3+: 0,02 mol; Cu2+: 0,015 mol; SO42- = 0,02 mol; NO3- = (0,5 – 0,07 = 0,43 mol) và có thể có H+
Bảo toàn điện tích → nH+ = 0,38 mol
Cho Cu vào Y có phản ứng:
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
0,1425 ← 0,38 0,43 mol
Cu + 2Fe3+ → Cu2+ + 2Fe2+
0,01 ← 0,02 mol
m = (0,01 + 0,1425).64 = 9,76 gam.

nCu=0.12 mol
nH+=0.32 mol
nNO3-=0.12 mol
nSO42-0.1
3Cu + 8H+ + 2NO3- -----> 3Cu2+ + 2NO + 4H2O
0.12----0.32----0.12
mM'= 7.68+ 0.1*96 + 0.04*62=19.76g =>C

Chọn đáp án C
Gọi số mol của NaBr là x mol; NaI là y mol.
Cho B r 2 vào dung dịch A, chỉ NaI phản ứng.
NaI + 1 2 Br2 → NaBr + 1 2 I2
1 mol NaI → 1 mol NaBr khối lượng giảm 47g
→ n N a I = 7 , 05 47 = 0,15 mol = y
Khi sục khí Clo vào dung dịch A, cả NaBr và NaI phản ứng.
m m u ố i g i ả m = x.(80 – 35,5) + y (127-35,5) = 22,625 g
→ x = 0,2 mol
ð % m N a B r = 0 , 2 . 103 0 , 2 . 103 + 0 , 15 . 150 .100(%) = 47,80(%)