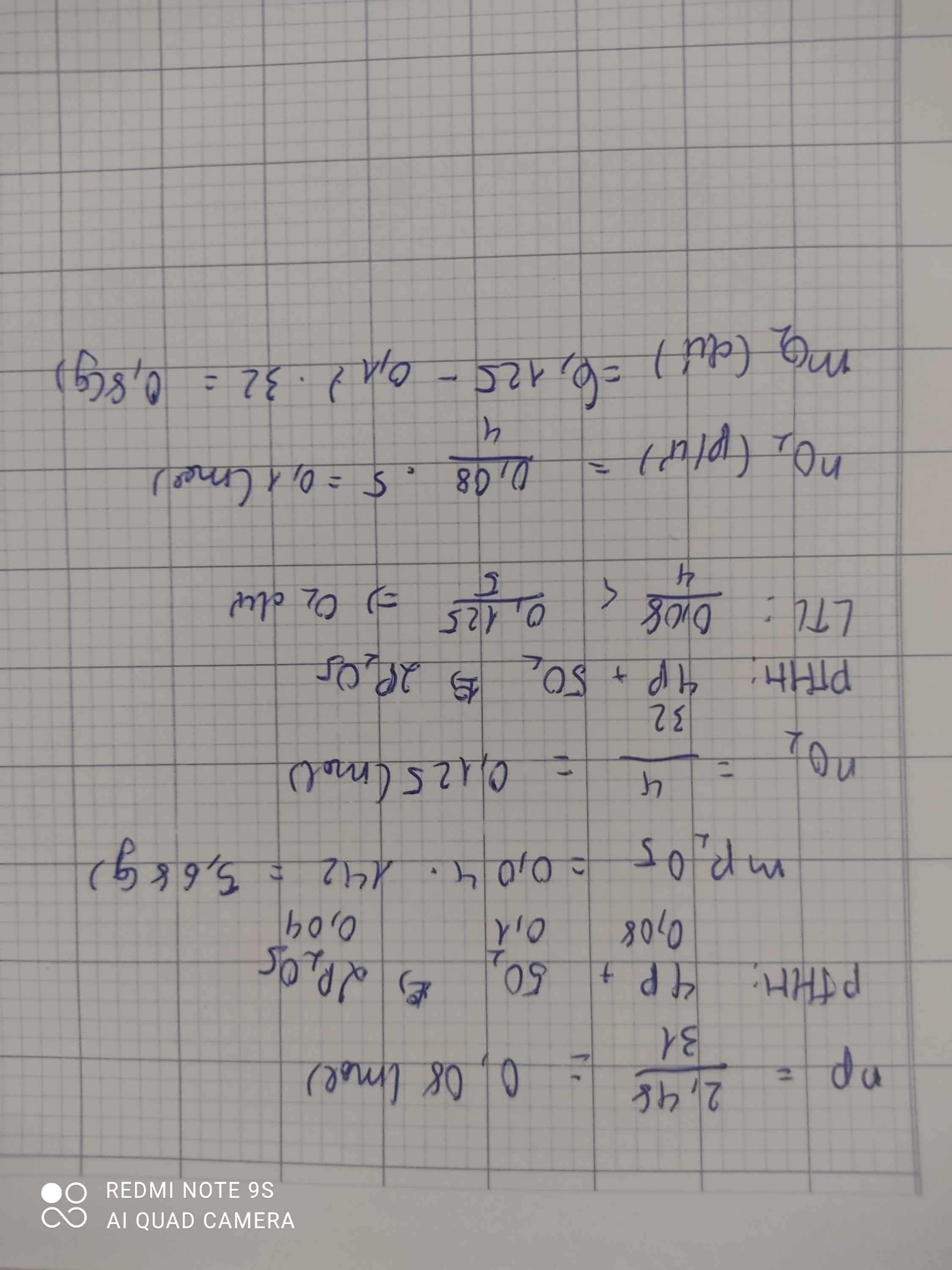Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a) Zn + H_2SO_4 \to ZnSO_4 + H_2\\ n_{Zn} = \dfrac{13}{65} = 0,2 < n_{H_2SO_4} = \dfrac{200.24,5\%}{98} = 0,5 \to H_2SO_4\ dư\\ n_{H_2SO_4\ pư} =n_{Zn} = 0,2(mol)\\ \Rightarrow m_{H_2SO_4\ dư} = (0,5 - 0,2).98 = 29,4(gam)\\ c) n_{FeSO_4} = n_{H_2} = n_{Zn} = 0,2(mol)\\ m_{FeSO_4} = 0,2.152 = 30,4(gam)\\ V_{H_2} = 0,2.22,4 = 4,48(lít)\)

a) \(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
\(n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2
0,25 0,5 0,5 0,5
Xét tỉ lệ : \(\dfrac{0,3}{1}>\dfrac{0,5}{2}\) => Zn dư , HCl đủ
b) \(m_{Zn\left(dư\right)}=\left(0,3-0,25\right).65=3,25\left(g\right)\)
c) \(m_{ZnCl_2}=0,25.136=34\left(g\right)\)
\(V_{H_2}=0,25.22,4=5,6\left(l\right)\)
\(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\\ n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\\ a,Zn+2HCl\rightarrow ZnCl_2+H_2\\b, Vì:\dfrac{0,5}{2}< \dfrac{0,3}{1}\Rightarrow Zndư\\ n_{Zn\left(dư\right)}=0,3-\dfrac{0,5}{2}=0,05\left(mol\right)\\ \Rightarrow m_{Zn\left(dư\right)}=0,05.65=3,25\left(g\right)\\ c,n_{ZnCl_2}=n_{H_2}=\dfrac{0,5}{2}=0,25\left(mol\right)\\ \Rightarrow m_{ZnCl_2}=0,25.136=34\left(g\right)\\ V_{H_2\left(đktc\right)}=0,25.22,4=5,6\left(l\right)\)

a)
\(3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4\)
b)
Ta có :
\(n_{Fe} = \dfrac{8,4}{56} = 0,15(mol)\\ n_{O_2} = \dfrac{96}{32} = 3(mol)\)
Ta thấy : \(\dfrac{n_{Fe}}{3} = 0,05 < \dfrac{n_{O_2}}{2} = 1,5\) do đó O2 dư.
Theo PTHH :
\(n_{O_2\ pư} = \dfrac{2}{3}n_{Fe} = 0,1(mol)\\ \Rightarrow n_{O_2\ dư} = 3 - 0,1 = 2,9(mol)\\ \Rightarrow m_{O_2\ dư} = 92,8(gam)\)
c)
\(n_{Fe_3O_4} = \dfrac{1}{3}n_{Fe} = 0,05(mol)\\ \Rightarrow m_{Fe_3O_4} = 0,05.232 = 11,6(gam)\)
\(a)PTHH:FeCl_3+2O_2\xrightarrow[]{t^o}Fe_3O_4\)
mol 1 2 1
mol
\(b)\)Số mol \(FeCl_3\) là: \(n_{FeCl_3}=\dfrac{m_{FeCl_3}}{M_{FeCl_3}}=\dfrac{8,4}{162,5}=0,052\left(mol\right)\)
Số mol \(O_2\) là: \(n_{O_2}=\dfrac{m_{O_2}}{M_{O_2}}=\dfrac{96}{32}=3\left(mol\right)\)
Lập tỉ lệ: \(\dfrac{1}{0,052}>\dfrac{2}{3}\Rightarrow FeCl_3dư\)
Số mol \(FeCl_3\) phản ứng là:
Từ PTHH\(\Rightarrow\) \(n_{FeCl_3}=\dfrac{0,052\times3}{3}=0,035\left(mol\right)\)
Số mol \(FeCl_3\) dư là: \(n_{FeCl_3dư}=n_{FeCl_3đầu}-n_{FeCl_3p/ứng}=0,052-0,035=0,018\left(mol\right)\)
Khối lượng \(FeCl_3\) dư là: \(m_{FeCl_3dư}=n_{FeCl_3dư}\times M_{FeCl_3}=0,018\times162,5=2,925\left(g\right)\)

a)
\(4P + 5O_2 \xrightarrow{t^o} 2P_2O_5\)
b)
Ta thấy :
\(\dfrac{n_P}{4} = \dfrac{\dfrac{12,4}{31}}{4} =0,1 < \dfrac{n_{O_2}}{5} = \dfrac{\dfrac{20}{32}}{5} = 0,125\)
do đó, O2 dư
\(n_{O_2\ pư} = \dfrac{5}{4}n_P = 0,5(mol)\\ \Rightarrow n_{O_2\ dư} = \dfrac{20}{32} - 0,5 = 0,125(mol)\)
c)
\(n_{P_2O_5} = \dfrac{1}{2}n_P = 0,2(mol)\\ \Rightarrow m_{P_2O_5} =0,2.142 = 28,4(gam)\)

a, \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
b, \(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\)
\(n_{O_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2}{4}< \dfrac{0,4}{5}\), ta được O2 dư.
Theo PT: \(n_{O_2\left(pư\right)}=\dfrac{5}{4}n_P=0,25\left(mol\right)\Rightarrow n_{O_2\left(dư\right)}=0,4-0,25=0,15\left(mol\right)\)
\(\Rightarrow m_{O_2\left(dư\right)}=0,15.32=4,8\left(g\right)\)
c, Theo PT: \(n_{P_2O_5}=\dfrac{1}{2}n_P=0,1\left(mol\right)\Rightarrow m_{P_2O_5}=0,1.142=14,2\left(g\right)\)
d, \(m_{P_2O_5}=14,2.80\%=11,36\left(g\right)\)

nP = 2,48/31 = 0,08 (mol)
PTHH: 4P + 5O2 -> (t°) 2P2O5
Mol: 0,08 ---> 0,1 ---> 0,04
mP2O5 = 0,04 . 142 = 5,68 (g)
b) nO2 = 4/32 = 0,125 (mol)
So sánh: 0,125 > 0,1 => O2 dư
nO2 (dư) = 0,125 - 0,1 = 0,025 (mol)
mO2 (dư) = 0,025 . 32 = 0,8 (g)